
| A. | 0.5 a L | B. | a L | C. | 2 a L | D. | 3 a L |
分析 发生反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,H2、CO(体积比为3:2)的混合气体aL,分别$\frac{3a}{5}$,$\frac{2a}{3}$结合方程式可知,一定体积的混合气体耗氧量取决于V(CO+H2)的总量,与CO、H2的相对多少无关,以此解答.
解答 解:发生反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,H2、CO(体积比为3:2)的混合气体VL,分别$\frac{3a}{5}$,$\frac{2a}{3}$结合方程式可知,结合方程式可知,一定体积的混合气体耗氧量取决于V(CO+H2)的总量,与CO、H2的相对多少无关,则其完全燃烧时所需O2体积为aL×$\frac{1}{2}$=0.5aL,
故选A.
点评 本题考查混合物的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,根据方程式确定相同体积的CO、H2消耗氧气的体积相同是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(生石灰) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 检验FeCl3溶液的Fe2+ | 向溶液中加入酸性KMnO4溶液 |
| B | 比较CH3COOH和HCN的酸性强弱 | 用pH计分别测定CH3COONa、NaCN饱和溶液的pH |
| C | 制备H2SiO3胶体 | 向Na2SiO3溶液中滴加过量HCl |
| D | 除去乙酸乙酯中的CH3COOH | 加入饱和Na2CO3溶液,振荡后静置,分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{14}$ mol•L-1 | B. | $\frac{4}{5}$ mol•L-1 | C. | $\frac{1}{28}$ mol•L-1 | D. | $\frac{1}{42}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4g | B. | 11.2g | C. | 5.6g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
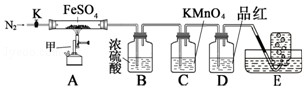
| 实验 | 滴定管 开始读数 | 滴定 终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| B. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com