
【题目】下列叙述正确的是
A. 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
B. 胶体的本质特征是丁达尔效应
C. 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D. 宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是氢氧化铜
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下列十种物质:①蔗糖②熔融NaCl③石墨④铜丝⑤NaOH固体⑥SO2⑦NaHSO4固体⑧K2O固体⑨液态H2SO4⑩饱和FeCl3溶液 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①NaHSO4晶体熔化时的电离方程式为______________________________。
②3 mol·L-1 NaHSO4与2 mol·L-1 Ba(OH)2溶液等体积混合,该反应总的离子方程为___________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________(填序号),反应的离子方程式为________________________________________________。
(4)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+,已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A. CuCl2[CuSO4] B. NaOH[NaOH] C. CuSO4[Cu(OH)2] D. NaCl[HCl]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+1/2O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是
A. -441.8 kJ·mol-1 B. -254.6 kJ·mol-1
C. -438.9 kJ·mol-1 D. -260.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu 2(OH)3C1],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下:

己知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)。
[CuCl3]2-(aq)。
请回答:
(1)下列叙述正确的是__________。
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇![]()
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:

①装置D的作用是_______________。
②C中反应的离子方程式为_____________。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是________________。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、____________。
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为____________。
②产品中CuCl的纯度为__________(本实验条件下,Cl-难于被MnO4-氧化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) +O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99KJ/mol。请回答下列问题:
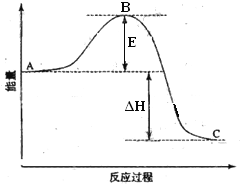
①图中A、C分别表示________、_______;
②E表示________;E的大小对该反应的反应热____(填“有”或“无”)影响。
③该反应通常用V2O5作催化剂,加V2O5会使图△H______(填“变大”、“变小”或“不变”),图中△H =______KJ/mol;
④已知单质硫的燃烧热为296 KJ/mol,计算由S(s)生成3molSO3(g)的△H=________KJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两串联电解池,左边放硫酸铜,右边放一定量的某硝酸盐溶液,电解时当左池有1.6g Cu析出时,右池析出0.45g固体,则右池溶质为:
A.AgNO3 B.NaNO3 C.Mg(NO3)2 D.Al(NO3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 将2mol Cl2通入到含1mol FeI2的溶液中: | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: | 正确;说明酸性: |
D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com