
【题目】制备一氯乙烷最好采用的方法是( )
A. 乙烷和氯气取代反应 B. 乙烯与氯气加成反应
C. 乙烯与HCl加成反应 D. 乙炔与HCl加成反应
科目:高中化学 来源: 题型:
【题目】镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A. Fe3+ B. Cu2+ C. Al3+ D. AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
A13+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH步骤中,溶液pH的调节范围是______________。
(2)滤渣1和滤渣3主要成分的化学式分别是_____________、__________________。
(3)酸浸过程中,1 molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________________________________。
(4)沉镍过程中,若c(Ni2+)=2.0mol·L-1,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1,则需要加入Na2CO3固体的质量最少为_________g。(保留小数点后1位有效数字)。
(5)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 1 mol乙烷和1 mol乙烯中,化学键数相同
C. 1 mol D2O与1 mol H2O中,中子数比为2∶1
D. 同等质量的氧气和臭氧中,电子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与安全事故处理不正确的是( )
A.用试管夹从试管底部由下往上夹住距试管口约1/3处,手持试管夹长柄末端进行加热
B.将CO中毒者移动到通风处抢救
C.实验中剩余的钠不能再放回原试剂瓶
D.蒸馏烧瓶加热时需要垫石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。[Cu(NH3)4]SO4中化学键类型有_______,阴离子中心原子杂化类型为______。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用480 mL 0.5 mol·L-1的NaOH溶液。
(1)该同学应选择________ mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的__________(填选项字母)之间。

A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。

(4)下列操作对所配溶液的浓度偏大的有(填写下列序号)(_________)
①转移完溶液后未洗涤玻璃棒和烧杯 ②容量瓶中原来有少量蒸馏水
③摇匀后发现液面低于刻度线再加水 ④定容时观察液面俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
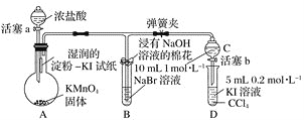
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是____________________________。
(4)过程Ⅲ实验的目的是________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com