
 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:分析 (1)①产生能使品红溶液褪色的气体为SO2,还生成HCl;
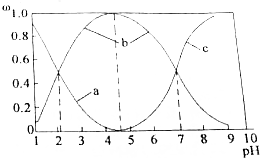
②与SOCl2中硫元素同价态的硫的含氧酸为H2SO3,随碱性增强,H2SO3浓度减小、HSO3-浓度增大,碱性较强时主要以SO32-存在,亚硫酸二级电离为:HSO3-?H++SO32-,二级电离常数Ka2=$\frac{c({H}^{+})×c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$,由图可知pH=7时,溶液中c(HSO3-)=c(SO32-);
(2)①设AlCl3•6H2O为2mol,由Al元素守恒可知Al2(OH)nCl(6-n)为1mol,再结合$\frac{m(碱式氯化铝)}{m(起始AlC{l}_{3}•6{H}_{2}O)}$×100%=40%计算;
②SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,产物SO2和HCl抑制AlCl3水解;
(3)SOCl2加热到一定温度可分解生成Cl2、SO2、S2Cl2,配平书写方程式,反应中氯气是氧化产物,S2Cl2还原产物,根据Cl化合价变化计算生成氯气物质的量;
(4)电池总反应为:4Li+2SOCl2 4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2.
4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2.
解答 解:(1)①产生能使品红溶液褪色的气体为SO2,还生成HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
②与SOCl2中硫元素同价态的硫的含氧酸为H2SO3,随碱性增强,H2SO3浓度减小、HSO3-浓度增大,碱性较强时主要以SO32-存在,a为H2SO3,b为HSO3-,c为SO32-,
亚硫酸二级电离为:HSO3-?H++SO32-,二级电离常数Ka2=$\frac{c({H}^{+})×c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$,由图可知pH=7时,溶液中c(HSO3-)=c(SO32-),则二级电离常数Ka2=$\frac{c({H}^{+})×c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$=c(H+)=10-7,
故答案为:H2SO3、HSO3-、SO32-;10-7;
(2)①设AlCl3•6H2O为2mol,由Al元素守恒可知Al2(OH)nCl(6-n)为1mol,则$\frac{54+17n+35.5(6-n)}{2×(27+3×35.5+6×18)}$×100%=40%,解得n=4
②AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解,
故答案为:AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(3)SOCl2加热到一定温度可分解生成Cl2、SO2、S2Cl2,反应方程式为:4SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$3Cl2↑+2SO2↑+S2Cl2,反应中氯气是氧化产物,S2Cl2还原产物,当转移3mol电子时,所得氧化产物的物质的量为$\frac{3mol}{2}$=1.5mol,
故答案为:4SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$3Cl2↑+2SO2↑+S2Cl2;1.5mol;
(4)电池总反应为:4Li+2SOCl2 4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
故答案为:4Cl-+S+SO2-4e-=2SOCl2.
点评 本题考查较为综合,涉及弱电解质的电离、陌生方程式书写、盐类水解、氧化还原反应、原电池与电解原理等知识,侧重于学生的分析能力和计算能力的考查,属于易错题目,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-、Na+、SO42-、NO3- | B. | Na+、Mg2+、S2-、SO${\;}_{{3}^{\;}}$2- | ||
| C. | Na+、K+、Cl-、OH- | D. | K+、Ca2+、H+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
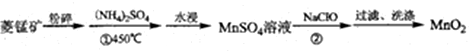
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:SiO2<CO2 | B. | 沸点:H2O<H2S | ||
| C. | 晶格能:CaCl<NaCl | D. | 热稳定性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 氯气的氧化性 | 将湿润的淀粉KI试纸放于充满 Cl2的集气瓶口,试纸变蓝 |
| B | 配制 480mL 0.2mol/L NaOH溶液 | 准确称量NaOH固体4.0g溶于水,配制成 500mL溶液 |
| C | 比较 H2CO3 和 H2SO4的酸性强弱 | 室温下,用PH试纸测定浓度为O.lmol•L-1Na2CO3溶液和 0.lmol•L-1NazSO4溶液的 pH |
| D | 证明氧化性: H2O2>Fe3+ | 用硫酸酸化的H2O2滴入Fe(NO3)2洛液中,浓液变黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com