
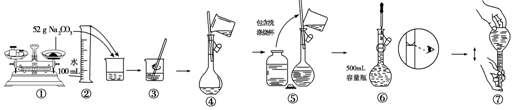
| A. | ⑤⑥ | B. | ②④⑦ | C. | ①⑥ | D. | ⑤⑥⑦ |
分析 据图示配制操作可知,步骤①使用托盘天平称量碳酸钠质量时,砝码与药品的位置颠倒了;步骤⑥中定容时仰视刻度线,该操作是错误的,正确应该平视刻度线.
解答 解:配制一定物质的量浓度的溶液步骤有:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀等,
操作①中称量碳酸钠质量,药品与砝码位置颠倒,正确方法应该为“左物右码”,否则导致称量的碳酸钠质量偏小,故①错误;
操作②、③为溶解碳酸钠,使用玻璃棒搅拌,加速溶解过程,操作正确,故②③正确;
步骤④为转移冷却后的碳酸钠溶液,需要使用玻璃棒引流,玻璃棒下端放到容量瓶刻度线一下,过程中正确,故④正确;
步骤⑤为转移洗涤烧杯、和玻璃棒的溶液即直接加水定容,当加水到容量瓶刻度线1-2cm时停止,需要改用胶头滴管,该操作正确,故⑤正确;
操作⑥为使用胶头滴管定容,定容时眼睛应该与容量瓶刻度线平视,不能仰视刻度线,故⑥错误;
操作⑦为摇匀操作,摇匀时应该上下颠倒充分摇匀,故⑦正确;
所以以上错误操作有①⑥,
故选C.
点评 本题考查了配制一定物质的量浓度的溶液中的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 | |
| B. | 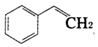 中所有原子可能共平面 中所有原子可能共平面 | |
| C. | 1 mol苹果酸(HOOCCHOHCH2COOH)可与3mol NaHCO3发生反应 | |
| D. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称取无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 容量瓶中原来留有一点蒸馏水,没有干燥 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转、摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 乙醇与浓硫酸在140℃时共热:CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH2═CH2↑+H2O | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$ | |
| D. | 用18O标记的乙醇与乙酸发生酯化反应:C2H518OH+CH3COOH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
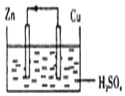
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 在该原电池中,铜作负极 | |
| C. | 电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com