
| ʵ�� ��� | ʵ����� | �������� |
| �� | �ⱥ��NaHCO3��Һ��pH | pHΪ8.3 |
| �� | ��2mL Na2CO3��Һ�м���MgCl2��Һ | �а�ɫ�������� |
| �� | ��2mL����NaHCO3��Һ�м���MgCl2��Һ | ���������� |
| �� | ��20mL ����NaHCO3��Һ�м���������NaHCO3���壬����24Сʱ | ��Һ��С�����建���شӵײ������ݳ������չ���ȫ���ܽ� |
���� ��1��Ϊǿ�������Σ�ˮ��ʼ��ԣ�
��2����֪Ksp��CaCO3��=4.96��10-9��Ksp��MgCO3��=6.82��10-6��������̼��Ƴ�����
��3������Ӧ�����Һ�еμ�MgCl2��Һ���а�ɫ�������ɣ����ɳ���Ϊ̼��þ��
�ڱ���NaHCO3��Һ�й����ܽ⣬��Һ�д���2HCO3-��aq��?CO32- ��aq��+CO2��+H2O ��l��������CO2�����ݳ�����ʹƽ�������ƶ���
������CO32-����Һ������ǿ��
��4��ʵ��ۼ����Ȼ�þ��û�г������ɣ���˵��̼�������Ũ�ȼ�С��
��5����ʵ��ܿ�֪����NaHCO3��Һ�����ܽ�����NaHCO3���壮
��� �⣺��1��̼������Ϊǿ�������Σ�ˮ��ʼ��ԣ����ӷ���ʽΪHCO3-+H2O?H2CO3+OH-���ʴ�Ϊ��HCO3-+H2O?H2CO3+OH-��
��2����Һ�д���ƽ��HCO3-?CO32-+H+����֪Ksp��CaCO3��=4.96��10-9��Ksp��MgCO3��=6.82��10-6��Ksp��CaCO3����Ksp��MgCO3����˵��Ca2+���CO32-������Mg2+ǿ�����Կ��Եõ�CaCO3������
�ʴ�Ϊ����Һ�д���ƽ��HCO3-?CO32-+H+��Ksp��CaCO3����Ksp��MgCO3����˵��Ca2+���CO32-������Mg2+ǿ�����Կ��Եõ�CaCO3������
��3������Ӧ�����Һ�еμ�MgCl2��Һ���а�ɫ�������ɣ����ɳ���Ϊ̼��þ���ʴ�Ϊ��MgCO3��
�ڱ���NaHCO3��Һ�й����ܽ⣬��Һ�д���2HCO3-��aq��?CO32- ��aq��+CO2��+H2O ��l��������CO2�����ݳ�����ʹƽ�������ƶ���
�ʴ�Ϊ����ϵ�д���ƽ�⣺2HCO3-��aq��?CO32- ��aq��+CO2��+H2O ��l��������CO2�����ݳ���ƽ�������ƶ��������ܽ⣻
������CO32-��ˮ��̶ȴ���̼��������ӣ���Һ������ǿ��������ҺpH���ߣ�
�ʴ�Ϊ����Ӧ������CO32-����̼�����ij������Ƴ�Na2CO3���Դ���NaHCO3��������ҺpH���ߣ�
��4��ʵ��ۼ����Ȼ�þ��û�г������ɣ���˵��̼�������Ũ�ȼ�С��������MgCl2��Һ����������
�ʴ�Ϊ����֤���鱥��NaHCO3��Һ��CO32-���٣�������MgCl2��Һ����������
��5����ʵ��ܿ�֪����NaHCO3��Һ�����ܽ�����NaHCO3���壬�ʴ�Ϊ������NaHCO3��Һ�п����ܽ�������NaHCO3���壮
���� ���⿼�����ʵĺ����IJⶨ��Ϊ��Ƶ���㣬���ؿ���ѧ���ķ���������ʵ��������ע��������ʵ������Լ�ʵ���ԭ�����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
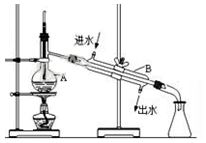
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2mol/L NaOH��Һ | B�� | 2mol/LH2SO4��Һ | C�� | 2mol/LMgSO4��Һ | D�� | FeCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH��OH��CH2COOHϵͳ����������3-�ǻ����� | |
| B�� | �ı�����ϩ��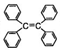 ��������̼ԭ��һ������ͬһƽ�� ��������̼ԭ��һ������ͬһƽ�� | |
| C�� | lmol 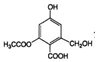 �ֱ���������Na��NaOH��Һ��NaHCO3��Һ��Ӧ���������������ʵ����ʵ����ֱ���3mol��4mol��1mol �ֱ���������Na��NaOH��Һ��NaHCO3��Һ��Ӧ���������������ʵ����ʵ����ֱ���3mol��4mol��1mol | |
| D�� | ��һ�������£�����Һ�塢Ũ���������屽���������ķ�Ӧ������ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
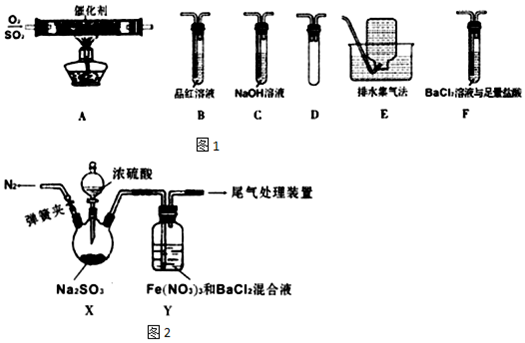
| ʵ�鲽�� | ����ͽ��� |
| �ٲⶨY�л����Һ��pH�� �������벽�������ͬpH��ϡ������BaCl2�Ļ��Һ����ͨ������N2�� �۽�SO2ͨ�벽�������Һ�� | �����ְ�ɫ���������1�������������ְ�ɫ���������1�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
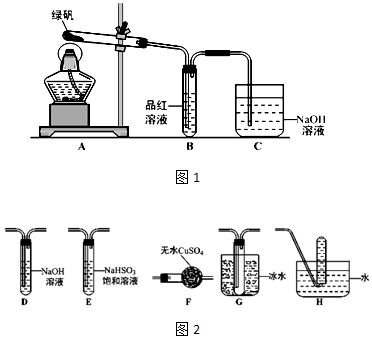
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
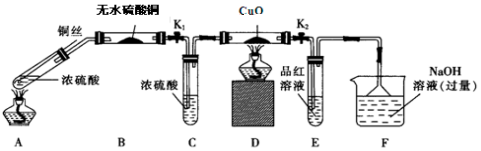
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
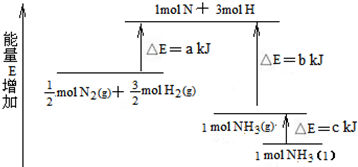
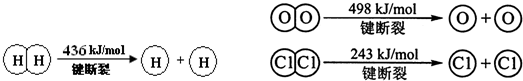
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com