
| 现象 | 单质B的相关性质(填序号) | 相关的化学方程式 | |
| Ⅰ | 单质B浮在水面上 | ||
| Ⅱ | 熔成一个小球 | ||
| Ⅲ | 四处游动,发出嘶嘶的声音 | ||
| Ⅳ | 滴入酚酞试剂,溶液变红 |
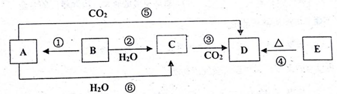
分析 物质A~E均含同种元素,都是中学化学中常见的物质,A是一种淡黄色的固体,能和CO2、H2O反应,则A是Na2O2,C是NaOH,D是Na2CO3,B是银白色金属单质,能和水反应,且可以反应得到过氧化钠,则B是Na,E加热得到碳酸钠,则E为NaHCO3,据此解答.
解答 解:物质A~E均含同种元素,都是中学化学中常见的物质,A是一种淡黄色的固体,能和CO2、H2O反应,则A是Na2O2,C是NaOH,D是Na2CO3,B是银白色金属单质,能和水反应,且可以反应得到过氧化钠,则B是Na,E加热得到碳酸钠,则E为NaHCO3.
(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,氧化剂是Na2O2,还原剂是 Na2O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;Na2O2;Na2O2;
(2)反应②为2Na+2H2O=2NaOH+H2↑,反应现象对应的性质为:
| 现象 | 单质B的相关性质(填序号) | 相关的化学方程式 | |
| Ⅰ | 单质Na浮在水面上 | ④ | 2Na+2H2O=2NaOH+H2↑ |
| Ⅱ | 熔成一个小球 | ③ | |
| Ⅲ | 四处游动,发出嘶嘶的声音 | ⑤ | |
| Ⅳ | 滴入酚酞试剂,溶液变红 | ② |
| 现象 | 单质B的相关性质(填序号) | 相关的化学方程式 | |
| Ⅰ | 单质Na浮在水面上 | ④ | 2Na+2H2O=2NaOH+H2↑ |
| Ⅱ | 熔成一个小球 | ③ | |
| Ⅲ | 四处游动,发出嘶嘶的声音 | ⑤ | |
| Ⅳ | 滴入酚酞试剂,溶液变红 | ② |
点评 本题考查无机物推断,涉及钠元素单质化合物性质,以A的颜色及发生的反应为突破口采用正逆结合的方法进行推断,明确物质的性质是解本题关键,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


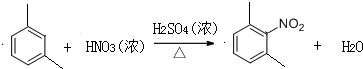 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
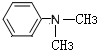 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+H2(g)?CH3CH2CH2CH3(g)△H1
(g)+H2(g)?CH3CH2CH2CH3(g)△H1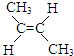 (g)+H2(g)?CH3CH2CH2CH3(g)△H2
(g)+H2(g)?CH3CH2CH2CH3(g)△H2| 温度(℃) | 300 | 320 | 340 |
| K1 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| K2 | 8.4×105 | 3.5×103 | 1.6×103 |
 (g)→
(g)→ (g)△H
(g)△H
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | pH=13的溶液中:Na+、CO32-、K+、HCO3- | |
| C. | 在无色溶液中:Cu2+、Ca2+、SO42-、Cl- | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com