
物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、CH3COOH、C2H5OH、HCl
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.铁粉与稀盐酸反应Fe+2H+=Fe3++H2↑
B.少量金属钠放入冷水中:Na + 2H2O = Na++ 2OH- + H2↑
C.氧化铜溶于硫酸:O2―+2H+=H2O
D.碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省宝鸡市岐山县高一上学期期中质量检测化学试卷(解析版) 题型:选择题
下列溶液氯离子的物质的量浓度与50mL 1 mol·L-1氯化铝溶液中氯离子的物质的量浓度相等的是
A.150 mL 1 mol·L-1氯化钠溶液 B.75 mL 1.0 mol·L-1氯化钙溶液
C.150 mL 3 mol·L-1氯化钾溶液 D.50 mL 3 mol·L-1氯化镁溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:填空题
已知:
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
H2CO3 | Ka1 = 4.2×10-7 | HClO | 3×10-8 |
Ka2 = 5.6×10-11 |
(1)用方程式表示HCN溶液显酸性的原因:______________________________。
(2)上述四种酸中,酸性最强的是 ;
(3)25℃时,0.01 mol/L NaCN溶液的pH________7;
(4)在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
(5)向pH=4的CH3COOH溶液中,加入下列物质,能使CH3COOH电离平衡向逆向移动的是:_________________。
①加入少量NH4Cl固体 ②加入等体积pH=5的盐酸
③加入少量Na2CO3固体 ④加入等体积0.01 mol/L的CH3COONa 溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:选择题
t℃时,水的离子积为Kw,该温度下混合可溶性一元酸HA和一元碱BOH。以下说法可确认混合后溶液一定呈中性的是( )
A.pH=7 B.c(A—) + c(OH—) = c(H+) + c(B+)
C.c(A—) = c(B+) D.c(OH—) =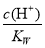
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高二上学期10月月考化学试卷(解析版) 题型:填空题
已知A(g)+B(s)  C(g)+D(g) △H<0,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B。回答下列问题:
C(g)+D(g) △H<0,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B。回答下列问题:
(1)如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率 (填“变大”、“变小”或“不变”);
(2)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(3)100℃时,该反应达到平衡后,D的浓度为0.02mol/L,改变反应温度为T,c(A)以0.001mol/(L·s)的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”或“小于”),判断理由是 ;
②温度T时,反应达到平衡后,将反应容器的体积减少一半。平衡向 (填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高二上学期10月月考化学试卷(解析版) 题型:选择题
对可逆反应2SO2+O2 2SO3,下列叙述正确的是( )
2SO3,下列叙述正确的是( )
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(SO2)∶n(O2)=2∶1
B.反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动
C.反应达到平衡后,再加入催化剂,平衡不移动,反应速率不再加快
D.当v正(SO2)∶v正(SO3)=1∶1时,说明该化学反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高一上学期10月月考化学试卷(解析版) 题型:填空题
(10分)
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为 _______ 。
(2) 等质量的CH4与 NH所含电子数之比是___ ,质子数之比是___ 。
(3)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均相对分子质量分别为_ ; ___ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省五校协作体高二上学期期中化学试卷(解析版) 题型:选择题
已知分解1mol H2O2放出热量98kJ。在含有少量I 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
H2O2+ I
 H2O+IO
H2O+IO 慢 H2O2+ IO
慢 H2O2+ IO
 H2O+O2+ I
H2O+O2+ I 快
快
下列有关该反应的说法正确的是
A.反应速率与I 浓度有关
浓度有关
B.IO 也是该反应的催化剂
也是该反应的催化剂
C.反应活化能等于98kJ·mol-1
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com