
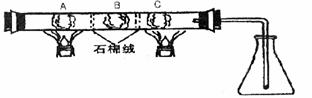
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
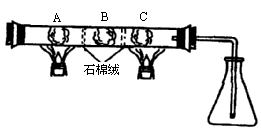
(1)C处(Pt为催化剂)发生反应的化学方程式是________
(2)若在NH4HCO3中预先加入适量的某种药品,再充分反应,可使锥形瓶中仅出现红棕色气体而无白烟,这种药品是________(填编号)(a.NaoH b.NaHCO3 c.NH4Cl).
(3)NH4HCO3与加入物的物质的量关系应满足:n(NH4HCO3)∶n(加入物)________.
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:阅读理解
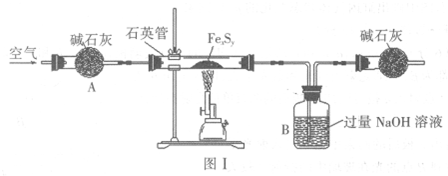
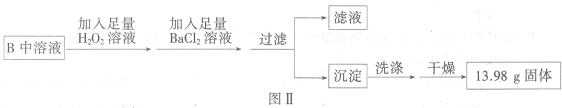
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 方案 质量 |
方案甲 | 方案乙 |
| U型管+固体 | 硬质玻璃管+固体 | |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
| 16(d+w-c) |
| c-d |
| 16(d+w-c) |
| c-d |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
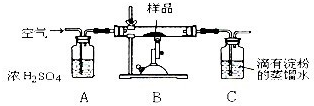
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一硬质玻璃管中进行下图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用。充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生。
(1)C处(Pt为催化剂)发生反应的化学方程式是
(2)若在NH4HCO3中预先加入适量的某种药品,再充分反应,可使锥形瓶中仅出现红棕色气体而无白烟,这种药品是 (填编号)
a、NaOH b、NaHCO3 c、NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com