
【题目】工业废水、废渣不经处理,会对环境造成很大的危害。利用化学原理可以对工厂排放的废水、废渣等进行有效检测、处理及应用。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,Cr(Ⅲ)最终转化为CrOH(H2O)5SO4。
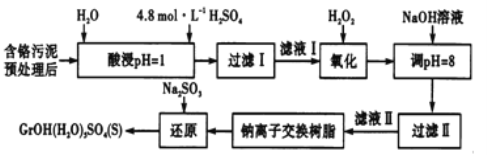
常温下,部分阳离子以氢氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒、量筒和胶头滴管外,还需_______,配制时所需浓H2SO4的体积为_______mL(小数点后保留一位数字)。
(2)酸浸时,为了提高浸取率,除了适当增大酸的浓度外,还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(5)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______。
(6)工业上还可用电解法制备重铬酸钠,其装置示意图如图.阴极的电极反应式为____________,阳极的电极反应式为____________。
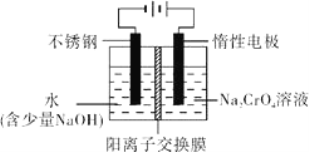
【答案】 250mL容量瓶 65.2 升高反应温度 加快搅拌速度 2Cr3++3H2O2+H2O=Cr2O72-+8H+ pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)的回收与再利用 Ca2+、Mg2+ 3Na2SO3+2Na2CrO4+15H2O=2CrOH(H2O)5SO4↓+Na2SO4+8NaOH 2H++2e-= H2↑(或4H2O+4e-= 2H2↑+4OH-) 4OH--4e-=2H2O+O2↑
【解析】分析:含铬污泥预处理后,用硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+,加入过氧化氢氧化铬离子为高价态,加入氢氧化钠溶液调节溶液PH=8使其他离子沉淀,过滤得到滤液用钠离子交换树脂交换镁离子和钙离子,得到溶液中通入Na2SO3还原得到Cr(OH)(H2O)5SO4,
(1)实验室用18.4mol·L-1的浓硫酸配制225mL4.8mol·L-1的H2SO4溶液,需要用250mL容量瓶配制,还用到胶头滴管;18.4mol/L×V=225mL×4.8mol/L,V=65.2mL;(2)酸浸时,为了提高浸取率,除了适当增大酸的浓度外,还可采取的措施有高反应温度、增大固体颗粒的表面积等措施,(答出一点即可)。(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,反应的离子方程式为:2Cr3++3H2O2+H2O=Cr2O72-+8H+;(4)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)的回收与再利用 。钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,钠离子交换树脂交换的离子是钙离子和镁离子。(5)Na2SO3具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为Na2SO4,Na2CrO4氧被还原为CrOH(H2O)5SO4,依据原子守恒分析书写配平3Na2SO3+2Na2CrO4+15H2O=2CrOH(H2O)5SO4↓+Na2SO4+8NaOH;(6)工业上还可用电解法制备重铬酸钠,其装置示意图如图.阴极的电极反应式为 2H++2e-= H2↑(或4H2O+4e-= 2H2↑+4OH-),阳极的电极反应式为 4OH--4e-=2H2O+O2↑。


科目:高中化学 来源: 题型:
【题目】(双选)下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:![]() —X,
—X,![]() —Y,×—Z)( )
—Y,×—Z)( )
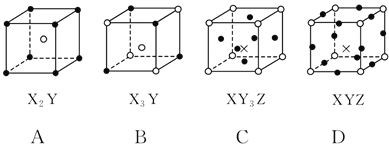
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO.下列叙述正确的是( )
2AlN+3CO.下列叙述正确的是( )
A. 氮化铝中氮元素的化合价为+3
B. AlN的摩尔质量为41g
C. 上述反应中每生成1molAlN,N2就得到3 mol电子
D. 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.H+、ClO-、Cl-、SO42-B.Na+、H+、CO32-、NO3-
C.Na+、H+、Cl-、NO3-D.K+、H+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
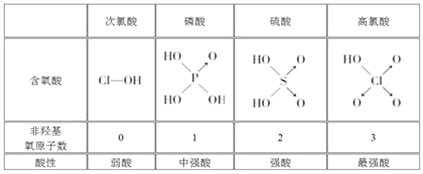
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸______________________,亚砷酸________________________。
(2)亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式分别是:
亚磷酸:______________________________________,
亚砷酸:_______________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,写出化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得不同物质中O—O键的键长和键能数据如下表。其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。
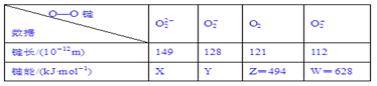
(1)键长与键能的关系规律是_________________________________________。
(2)键长与电子总数的关系规律是______________________________________。
(3)键能与电子总数的关系规律是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,某二元弱酸H2A溶液中离子浓度与pH的关系如图所示(y为lg [c(HA)/c(H2A)]或lg [c(A2)/c(H2A)]):下列说法不正确的是

A. 曲线b为lg[c(HA)/c(H2A)] 与pH的变化关系
B. 该温度下,H2A的Ka2约为104.1
C. 若在上图中作lg[c(HA) /c(A2)] ~ pH关系图,得到的曲线会与曲线b平行
D. 若升高温度,则图中曲线a、b上移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种元素的原子电子层结构如下:
A.1s22s22p63s23p63d54s1;B.1s22s22p63s2;C.1s22s22p6;D.1s22s22p63s23p;E.[Ar]4s1。试回答:
(1)哪个式子是错误的________,它违背了________。
(2)哪个式子表示稀有气体原子________。
(3)A的元素符号是________,写出其价电子排布的轨道表示式________。
(4)B和E的金属性强弱关系为________(用元素符号表示),可以说明这一事实的依据是(写出2点)__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com