
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:分析 (1)求出钠的物质的量,然后根据钠元素的化合价变化来分析;
(2)铝和铁都能把位于其后的金属从其盐溶液中置换出来,但铝的活泼性强于铁,铝先与盐溶液反应,然后铁与与盐溶液反应;
(3)根据溶液中含有硝酸,所以铁元素以Fe3+的形式存在,根据电荷守恒c(H+)+2c(Cu2+)+3c(Al3+)+3c(Fe3+)=c(NO3-),据此计算c(Fe3+),进而计算n(Fe3+),再根据Fe元素守恒计算原混合物中Fe的质量;
(4)计算氧元素质量分数,根据化学式中元素质量之比列方程计算;
(5)①Na和Al都属于金属,合金中Na较Al活泼,根据正极反应式知,原电池的电极材料Na-Al/FeS,判断出负极材料为Na,失去电子,化合价升高;又知该电池中正极的电极反应式为:2Na++FeS+2e-=Na2S+Fe,所以电池总反应为:2Na+FeS=Na2S+Fe,充电时为电解池原理,阳极发生氧化反应,失去电子,化合价升高;
②若通电5min时,铜电极质量增加1.08g,说明Cu为阴极,则X为负极,Y为正极,结合电极方程式解答该题.
解答 解:(1)2.3g钠的物质的量为0.1mol,而钠无论反应后产物是什么,钠元素反应后一定变为+1价,故0.1mol钠失去0.1mol电子,则失去的电子数为0.1NA;
故答案为:0.1NA;
(2)a.铝粉、铁粉都全部与溶液反应,且溶液过量,溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu,故a正确;
b.铝粉部分与溶液反应、铁粉与溶液未反应,溶液中有Fe2+、Al3+,不溶物为Cu、Fe,故b正确;
c.铝粉氯化铜溶液反应生成氯化亚铁和铜,不可能生成Fe3+,故c错误;
d.铝先与氯化铜溶液反应,然后铁与氯化铜溶液反应,只要铝剩余,铁与氯化铜溶液就不反应,溶液中就不可能含有Fe2+,故d错误;
故选:ab;
(3)溶液中含有硝酸,所以铁元素以Fe3+的形式存在,溶液中的电荷守恒:c(H+)+2c(Cu2+)+3c(Al3+)+3c(Fe3+)=c(NO3-),即 0.5mol/L+0.3mol/L×2+0.2mol/L×3+3c(Fe3+)=2mol/L,解得:c(Fe3+)=0.1mol/L,n(Fe3+)=0.1mol/L×1L=0.1mol,故m(Fe)=0.1mol×56g/mol=5.6克,
故答案为:5.6g;
(4)铁的某种氧化物的化学式表示为Fex0(x<1),铁元素在该氧化物中的质量分数为75%,则氧元素质量分数为25%,故56x:16=75%:25%,解得x=0.86,
故答案为:0.86;
(5)①Na性质活泼,易失去电子而被氧化,应为原电池的负极,电极方程式为2Na-2e-=2Na+,充电时,阳极发生氧化反应,电极方程式为Na2S+Fe-2e-=2Na++FeS,则阳极发生反应的物质是Na2S、Fe,
故答案为:2Na-2e-=2Na+;Na2S、Fe;
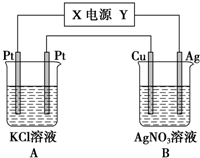
②若通电5min时,铜电极质量增加1.08g,说明Cu为阴极,则X为负极,Y为正极,A为电解KCl溶液,电解方程式为2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑,溶液pH增大,C中阳极上Ag失电子、阴极上银离子得电子,则溶液中氢离子或氢氧根离子浓度不变,溶液的pH不变,
故答案为:负极;增大;不变.
点评 本题考查的知识点较多,涉及元素化合物性质、混合物计算、原电池和电解原理等知识点,侧重于学生的分析能力的考查,题目难度中等.注意溶液中的电荷守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | 从柑桔中可提炼出苧烯(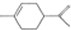 ),其分子式为C10H16,是1,3丁二烯的同系物 ),其分子式为C10H16,是1,3丁二烯的同系物 | |
| B. | 化学式为C4H10O的醇可被氧化成醛的有2种 | |
| C. | 2-氯丁烷(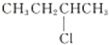 )与NaOH乙醇溶液共热发生消去反应的产物有2种 )与NaOH乙醇溶液共热发生消去反应的产物有2种 | |
| D. | 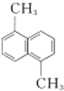 与 与 的一氯代物的数目不相等 的一氯代物的数目不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在氧气中燃烧 | |
| B. | 氢氧化钡晶体[Ba(OH)2•8H2O]与氯化铵晶体混合 | |
| C. | 锌与稀硫酸反应 | |
| D. | 氢氧化钡溶液与硫酸氢钠溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | $\frac{Vd}{MV+22400}$ | B. | $\frac{1000Vd}{MV+22400}$ | C. | $\frac{1000VdM}{MV+22400}$ | D. | $\frac{MV}{22.4(V+1)d}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器底部没有固体,则溶液中只有Cu2+ | |
| B. | 若容器底部固体既有铜又有铁,则溶液中只有Fe2+ | |
| C. | 若容器底部固体为铜,则溶液中可能有Cu2+和Fe3+ | |
| D. | 若容器底部无固体,再加入铁粉,溶液中阳离子的种类不发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com