
| A. | 将PH=a的NaOH溶液加水稀释至10n倍,则溶液的PH变为a-n | |
| B. | 等浓度的氨水和NH4Cl溶液等体积混合后:c(NH${\;}_{4}^{+}$)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | 向NaOH溶液中逐滴加入CH3COOH溶液至PH=7,水的电离程度逐渐增大 | |
| D. | PH=5.6的NaHSO3溶液:c(Na+)>c(HSO${\;}_{3}^{_}$)>c(H2SO3)>c(SO${\;}_{3}^{2-}$) |
分析 A、a-n可能小于7;
B、据电荷守恒和等物质的量的NH3•H2O 和NH4Cl混合溶液,一水合氨电离出铵根离子而抑制铵根离子水解,且一水合氨电离程度大于铵根离子水解程度分析;
C、向NaOH溶液中加入醋酸,发生中和反应,溶液碱性减弱,水的电离程度增大,当醋酸过量时抑制水的电离;
D、NaHSO3溶液的pH=5.6说明亚硫酸氢根离子的电离程度大于水解程度.
解答 解:A、NaOH加水稀释,溶液的pH不可能小于7,a-n有可能小于7,共A错误;
B、据电荷守恒有c(NH${\;}_{4}^{+}$)+c(H+)=c(Cl-)+c(OH-),等物质的量的NH3•H2O 和NH4Cl混合溶液,一水合氨电离出铵根离子而抑制铵根离子水解,且一水合氨电离程度大于铵根离子水解程度,溶液呈碱性,溶液中c(NH4+)>c(Cl-)>c(NH3•H2O),所以c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-),故B正确;
C、滴加醋酸溶液的过程中,所得溶液里水的电离程度逐渐增大,但当加入醋酸过量时,抑制水的电离,水的电离程度又减小,故C错误;
D、PH=5.6的NaHSO3溶液中亚硫酸氢根离子的电离程度大于其水解程度,所以c(SO32-)>c(H2SO3),故D错误;
故选B.
点评 本题考查了强碱溶液加水稀释时pH变化、溶液中的电荷守恒以及物料守恒、水的电离、离子浓度大小比较,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z2X4结构式
;Z2X4结构式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给烧杯中的液体加热时,不需垫石棉网 | |
| B. | 用药匙或者纸槽把粉末状药品送人试管的底部 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 给试管中的液体加热时管口不要对着白己和别人,以免液体暴沸伤人 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
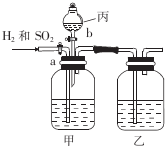 为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)
为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电解质 | a.HF | b.HNO2 | c.HCN | d.NH3.H2O | e.H2S |
| 电离平衡常数 | 7.2×10-4 | 4.6×10-4 | 4.9×10-10 | 1.8×10-5 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | e最弱 | B. | b最强 | ||
| C. | 由强到弱的顺序为a>b>d>e>c | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com