
【题目】下列过程中颜色变化与化学变化无关的是( )
A.银白色的金属铁研磨成铁粉后变成黑色
B.新切割开的金属钠的表面由银白色迅速变成暗灰色
C.红棕色的NO2通过装有水的洗气瓶后得到无色气体
D.浅黄绿色的新制氯水久置后变为无色
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】欲使醋酸溶液中的CH3COO-浓度增大,电离平衡向电离方向移动,且不放出气体,可向醋酸溶液中加入少量固体
A.NaOH B.NaHCO3 C.CH3COONa D.Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键 D.共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是( )
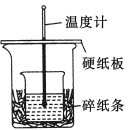
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填碎纸条的主要作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管往其中滴加5 mL盐酸。
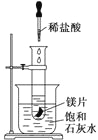
试回答下列问题:
(1)实验中观察到的现象是_____________________________________________。
(2)产生上述现象的原因是____________________________________________。
(3)写出有关反应的离子方程式______________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25℃的饱和石灰水”换成“20℃碳酸饮料”进行实验探究,实验中观察到的另一现象是________________________________________________________________,其原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3的制取方法及Na2CO3和NaHCO3综合实验探究
Ⅰ. (1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
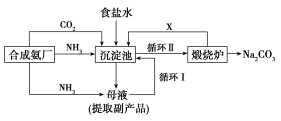
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是_______________________________________________。
②写出沉淀池中反应的化学方程式_______________________________________________。
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_______________________________________________。
(3)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:_______________________。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是________(填字母序号)。
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO浓度较大,能与CaCl2发生反应:Ca2++CO===CaCO3↓ (离子方程式) |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com