
【题目】反应:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑中被氧化的元素是( )
A.C
B.H
C.N
D.Ca
科目:高中化学 来源: 题型:
【题目】有机花儿会务X(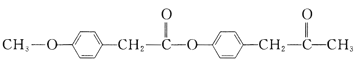 )是有机精细化工的重要中间体,实验室中以M(
)是有机精细化工的重要中间体,实验室中以M(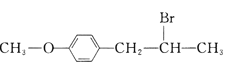 )为原料合成X的路线如下:
)为原料合成X的路线如下:
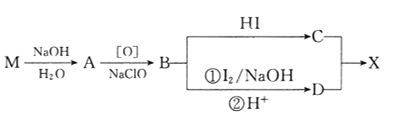

回答下列问题:
(1)B的核磁共振氢谱上有________组峰。
(2)D分子中含有的官能团有_________________________。(填名称)
(3)下列常见含钠试剂能与C反应的有______________。(填标号)
a.氯化钠 b.氢氧化钠 c.纯碱 d.碳酸氢钠
(4)由B转化为C的化学方程式为______________________________,该反应的反应类型是_______________________。
(5)E是D的同分异构体,在苯环的对位上各有一个取代基,能够发生银镜反应和水解反应,1molE与足量钠反应可生成0.5molH2,则E可能的结构有_____种。
(6)有机物F(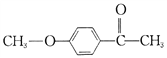 )也是一种重要的有机精细化工中间体,写出由
)也是一种重要的有机精细化工中间体,写出由 ![]() 制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:
制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:![]() )_________________.
)_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )

A. 1--5对应的结构中所有原子均可能处于同一平面的有1个
B. 1--5对应的结构均能使溴的四氯化碳溶液褪色
C. 1--5对应的结构中的一氯取代物只有1种的有3个
D. 1--5对应的结构均不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
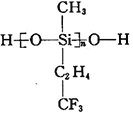
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(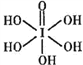 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)
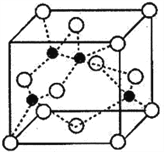
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“胃舒平”的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。下列叙述中错误的是( )
A. 镁元素基态原子的核外电子排布式是:1s22s22p63s2
B. 铝元素原子核外共有5种不同运动状态的电子
C. 钠元素离子半径比铝离子半径大
D. 金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑
【答案】B
【解析】试题分析:A.镁元素基态原子的核外电子排布式是:1s22s22p63s2,A正确;B.铝元素原子核外共有13种不同运动状态的电子,B错误;C.钠元素离子半径比铝离子半径大,C正确;D.金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑,D正确,答案选B。
考点:考查核外电子排布、微粒半径等有关判断
【题型】单选题
【结束】
17
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
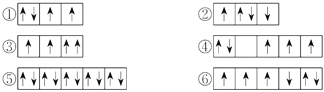
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂。以钼精矿(主要成分为MoS2)为原料制备金属钼和钼酸钠晶体的主要流程如图所示。
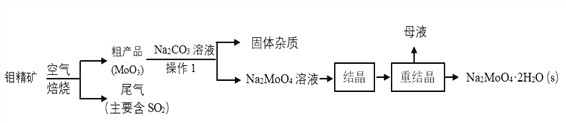
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;
(2)在焙烧反应中,每生成1mol MoO3时转移电子数为:_______ (以NA表示阿伏加德罗常数的值);
(3)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____;
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________;
(5)结晶操作前需加入Ba(OH)2固体以除去溶液中的SO42-,SO42-的最大去除率是_____(结果保留一位小数)[已知:碱浸液中c(MoO42-)=0.80mol·L-1,(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=4.0×10-8,Ba(OH)2引起的溶液体积变化忽略。]
(6)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
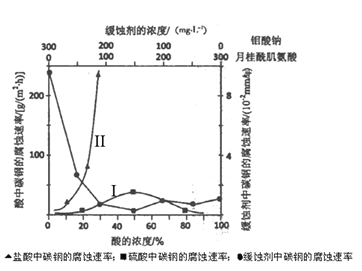
①试分析I、II曲线变化趋势不同的原因________________________________________
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________________________________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞结构如图所示,(![]() )X位于立方体的顶点,(○)Y位于立方体的中心,试分析:
)X位于立方体的顶点,(○)Y位于立方体的中心,试分析:

(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX=________(填角的度数)。
(4)若该立方体的棱长为a cm,晶体密度为ρ g·cm-3,NA为阿伏加德罗常数,则该离子化合物的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头 表示部分物质间的转化关系,下列说法正确的是( )
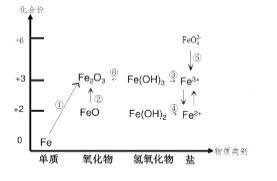
A. 铁与高温水蒸气的反应可实现上述转化①
B. FeO 是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
C. 由图可预测:高铁酸盐( FeO42- )具有强氧化性,可用于消毒。FeO42- 与水反应最终可生成 Fe(OH)3胶体,从而吸附水中的悬浮物,故高铁酸盐可用做净水剂
D. 加热 Fe(OH)3 发生转化⑥,加水溶解可实现转化③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com