
【题目】由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】A
【解析】
试题CO、H2和O2组成的混和气体,在一定条件下恰好完全反应,反应方程式是:2H2+O2![]() 2H2O;2CO+O2
2H2O;2CO+O2![]() 2CO2;根据反应方程式中物质反应的物质的量可知氧气的物质的量是氢气和一氧化碳的物质的量的和的一半。所以CO、H2的体积是2/3×60mL=40mL。在101kPa120℃时水是气体,反应产生的气体对氢气的相对密度是18.75,混合气体的相对密度是M=18.75×2=37.5。假设H2O、CO2的物质的量的比是x、y,则(18x+44y)÷(x+y)= 37.5,解得x:y=1:3,根据反应方程式可知1mol氢气反应产生1mol水蒸气;1molCo反应产生1molCO2,由于反应产生的H2O、CO2的物质的量的比1:3,所以在原混合气体中CO、H2的物质的量的比1:3,由于二者的总体积是40mL,所以氢气的体积是10mL,故原混和气体中H2所占的体积分数为10mL:60mL=
2CO2;根据反应方程式中物质反应的物质的量可知氧气的物质的量是氢气和一氧化碳的物质的量的和的一半。所以CO、H2的体积是2/3×60mL=40mL。在101kPa120℃时水是气体,反应产生的气体对氢气的相对密度是18.75,混合气体的相对密度是M=18.75×2=37.5。假设H2O、CO2的物质的量的比是x、y,则(18x+44y)÷(x+y)= 37.5,解得x:y=1:3,根据反应方程式可知1mol氢气反应产生1mol水蒸气;1molCo反应产生1molCO2,由于反应产生的H2O、CO2的物质的量的比1:3,所以在原混合气体中CO、H2的物质的量的比1:3,由于二者的总体积是40mL,所以氢气的体积是10mL,故原混和气体中H2所占的体积分数为10mL:60mL=![]() ,选项A正确。
,选项A正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是( )
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 温度升高H2的体积分数减小
D. 该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( )
A. 电解MgCl2溶液获取金属镁,用石墨作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D. 在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:
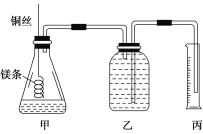
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO 4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O。下列说法不正确的是
A. 每转移1mole-,可以得到33g K2FeO4
B. □处的物质应为KCl
C. 该反应中铁元素的化合价升高
D. 氧化性:Cl2>K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取CO。下列有关说法正确的是
①木炭不完全燃烧制CO:2C(s)+O2(g)=2CO(g) ΔH1=-221kJ·mol-1
②木炭还原CO2制CO:C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
③焦炭还原Fe2O3制CO:Fe2O3(s) + 3C(s) ![]() 2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
A. 反应①中化学能全部转化为热能
B. 反应②为吸热反应,在任何情况下都不能自发进行
C. 反应③中使用催化剂或移走部分CO,均可提高Fe2O3的转化率
D. 反应Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) ΔH =-28.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下列反应:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)Cl2、KMnO4、H2SO4三者氧化性强弱顺序为______________,Cl-、SO2、Mn2+三者还原性强弱顺序为___________。
(2)反应①中氧化产物和还原产物的质量之比为________。
(3)反应②中浓盐酸表现出的性质是________。
A.还原性 B.酸性 C.氧化性
(4)用双线桥法标出反应②电子转移的方向和数目_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:1克碳粉燃烧全部生成CO气体时放出9.2kJ热量,2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________________________________________。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢可制取甲醛:
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
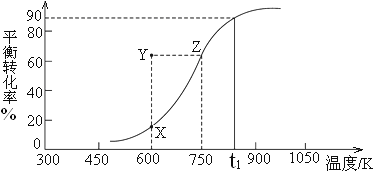
①该反应的ΔH___0 (填“>”或“<”);600K时,Y点甲醇的υ(正) ____υ(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, t1K时,该反应的平衡常数K=____________。
(3)研究表明,纳米级的Cu2O也可作为太阳光分解水的催化剂。
① 其他条件不变时,若水的分解反应使用Cu2O催化剂与不使用催化剂相比,使用催化剂会使该反应的活化能___________ (填“增大”、“减小”或“不变”),反应热(ΔH)______(填“增大”、“减小”或“不变”)。
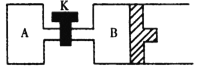
② 如图所示,当关闭K时,向容器A、B中分别充入0.04molH2O(g),起始时V(A) = V(B) = 2L。在一定条件下使水分解(反应过程中温度保持不变,B中活塞可以自由滑动),达到平衡时,V(B) = 2.4L。平衡时,两容器中H2O(g)的分解率A_____________B (填“<”、“=”或“>”)。打开K,过一段时间重新达平衡时,B的体积为____________L。(连通管中气体体积不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com