
下列有关叙述正确的是
A.非金属氧化物一定为酸性氧化物
B.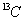 和
和 互为同位素,化学性质相似
互为同位素,化学性质相似
C.根据是否能产生丁达尔效应,将分散系分为溶液、浊液和胶体
D.已知红磷比白磷稳定,则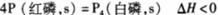
科目:高中化学 来源: 题型:
钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 (填元素符号)。
(2)[Ti(OH)2(H2O)4]2+中的化学键有 。
a.σ键 b.π键 c.离子键 d.配位键
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下图所示。
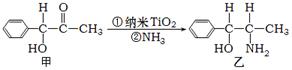
 化合物甲的分子中采取sp2杂化方式的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为 。
化合物甲的分子中采取sp2杂化方式的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为 。
(4)有一种氮化钛晶体的晶胞如右图所示,该晶体的化学式为 ,该晶体中Ti原子周围与它距离最近且相等的N原子的个数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.00 mol·L-1 NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。
(1)计算室温时20.00 mL 1.00 mol·L-1的一元酸
HA的电离度α=________。
 (2)图中B点所示的溶液中所含各离子浓度由
(2)图中B点所示的溶液中所含各离子浓度由
大到小的顺序是_____。
(3)下列说法正确的是________(填相应序号)。
A.由图中可知NaOH和HA反应的ΔH>0
B.图中C点所加NaOH溶液的体积V=20.00 mL
C.图中C点时溶液的KW略大于1×10-14 mol·L-1,溶液中c(H+)=1×10-7 mol·L-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入
0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的
部分情况如图所示。]回答下列问题:
① 在同一溶液中,H2CO3、HCO 、CO
、CO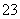
______(填“能”或“不能”)大量共存;
② 当pH=7时,溶液中含碳元素的主要微粒为________,溶液中各种离子的物质的量
浓度的大小关系为________________________________;
③ 已知在25 ℃时,CO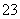 水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
液中c(HCO )∶c(CO
)∶c(CO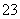 )=2∶1时,溶液的pH=________。
)=2∶1时,溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是( )。
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸乙酯是一种有香味的油状液体,请回答下列问题:
(1)写出实验室制取乙酸乙酯的化学反应方程式__________________________________,
该反应的反应类型是 。
(2)乙酸分子中官能团的名称是 。
(3)写出乙酸的一种用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.N和As属于第VA族元素2,N原子得电子能力比As原子强
B.族序数等于其周期序数的元素一定是金属元素
C.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素
D.Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向一定体积0.1 mol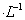 的氨水中逐滴滴加 0. 1mol
的氨水中逐滴滴加 0. 1mol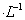 的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)] 的变化关系如右图所示,则下列说法中错误的是
的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)] 的变化关系如右图所示,则下列说法中错误的是
A.M点所示溶液中c( NH4+)>c(Cl-)
B.Q点所示溶液的导电熊力强于M点
C.Q点消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的电离程度相同

查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是( )
①2Fe3++2I-=2Fe2++I2②2Fe2++Cl2=2Fe3++2I-③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
A.FeCl2 B.KMnO4 C.浓盐酸 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
某亚硝酸钠生产厂采用硝酸为原料,其生产原理是NO+NO2+2NaOH===2NaNO2+H2O。工艺流程如下

(1)分解塔中填有大量的瓷环,其目的是:_____________________________。
(2)按一定计量比在反应塔中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则分解塔中发生反应的化学方程式为: ____________________________。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是_____________________________________,若硝酸浓度过高,吸收塔中可能发生的副反应化学方程式为_____________________________________________。
(3)通入一定量的N2的目的是: ___________________________________。
(4)吸收塔中尾气如何再利用:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com