
| A. | 1.7g H2O2中含有的电子数为0.9 NA | |
| B. | 等物质的量的N2和CO所含分子数均为NA | |
| C. | 1mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1 NA |
分析 A.双氧水中含有18个电子,其摩尔质量为34g/mol,1.7g双氧水的物质的量为0.05mol,含有0.9mol电子;
B.没有告诉氮气和一氧化碳的物质的量,无法计算其分子数;
C.过氧化钠中阴离子为过氧根离子,1mol过氧化钠中含有1mol阴离子;
D.戊烷在标准状况下为液态.
解答 解:A.1.7g双氧水的物质的量为0.05mol,0.05mol双氧水中含有0.9mol电子,含有的电子数为0.9NA,故A正确;
B.等物质的量的N2和CO所含分子数相等,没有告诉二者的物质的量,所以不一定为NA,故B错误;
C.1mol过氧化钠中含有1mol过氧根离子、2mol钠离子,总共含有3mol离子,含离子总数为3NA,故C错误;
D.戊烷在标准状况下为液态,故其2.24L不是0.1mol,故D错误.
故选A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项B为易错点,注意题中缺少气体的物质的量.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M:Na X:O2 | B. | M:HNO3 X:Fe | C. | M:NH3 X:O2 | D. | M:Al X:NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
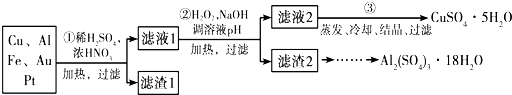

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
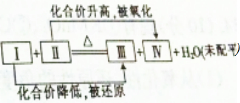 一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )| A. | H2SO4 | B. | CuSO4 | C. | Cu | D. | SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com