
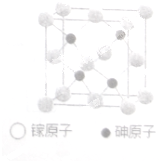
 砷化稼晶体广泛用于太阳能电池、新型光源LED和通讯领域.
砷化稼晶体广泛用于太阳能电池、新型光源LED和通讯领域.| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| A、氧化铝熔点高达2045℃,可用于制成坩埚熔化氢氧化钠固体 |
| B、合金大多具有良好的物理、化学或机械性能,可以用于制造货币中的硬币 |
| C、次氯酸具有还原性,可用于自来水的杀菌消毒 |
| D、钠的金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.
室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B、沉淀H为Al(OH)3、BaCO3的混合物 |
| C、溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D、若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
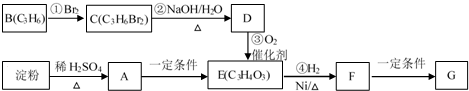
| H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca 2+ | Mg 2+ | Cl- | SO4 2- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com