
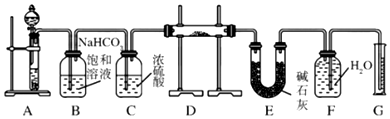
分析 (1)根据实验原理装置A采用的是碳酸钙和盐酸反应生成二氧化碳,根据碳酸钙和硫酸反应的情况来回答;
(2)获得的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,碱石灰可以吸收二氧化碳;
(3)根据氧化钠和过氧化钠的性质来回答;
(4)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度.
解答 解:(1)装置A是碳酸钙和盐酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,
故答案为:6mol/L盐酸;
(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;干燥气体;吸收装置D中反应剩余的二氧化碳;
(3)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;Na2O+CO2=Na2CO3;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02mol,
过氧化钠的纯度=$\frac{0.02mol×78g/mol}{2.0g}$×100%=78%,
故答案为:78%.
点评 本题考查学生过氧化钠的化学性质知识,通过实验方式考查增加了难度,综合性较强,题目难度中等.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲酸溶液导电性比乙酸溶液导电性强,说明乙酸是弱酸 | |
| B. | 硫酸钾溶于水能导电,所以硫酸钾是电解质 | |
| C. | 强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 | |
| D. | 固态磷酸是电解质,所以磷酸在熔融状态下和水溶液中都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | 非金属性:Cl>C>Si |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 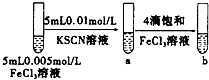 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=150 mL | B. | m1=14.6g | ||
| C. | 白色沉淀最大量为15.6g | D. | m2=10.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核较近的区域内运动 | |
| B. | 凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 | |
| C. | Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O-O共价键 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com