
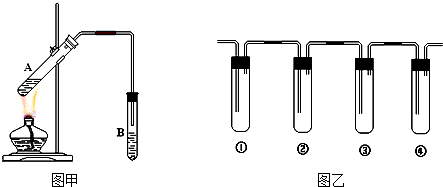
分析 I.(1)试管中试剂用于吸收乙酸乙酯,通常使用饱和碳酸钠溶液;
(2)试管B中的导管若伸入到液面下,容易发生倒吸现象;
(3)试管B不能使用橡皮塞,否则无法导入反应产物;
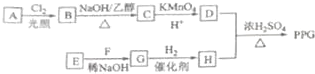
II.二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,据此进行解答(4)~(7);
(8)乙醇在浓硫酸存在条件下加热到140℃时发生分子间脱水生成乙醚.
解答 解:I.(1)蒸馏出的乙酸乙酯中含有乙醇、乙酸,制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,同时碳酸钠溶液降低乙酸乙酯的溶解度,便于析出、分层,所以B中为饱和碳酸钠溶液,
故答案为:饱和碳酸钠溶液;
(2)试管受热不均,小试管B中的导管伸入到液面下,可能发生倒吸,小试管B中的导管不伸入到液面下,可以防止倒吸,
故答案为:防止倒吸;
(3)根据装置甲可知,试管B使用了橡皮塞,该做法是错误的,否则反应产物无法导入试管,
故答案为:试管B口用了橡皮塞;
II.二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,
(4)因装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置②试管装有NaOH溶液除去SO2,装置③试管通过品红溶液不褪色确认SO2已除干净,装置④通过高锰酸钾酸性溶液褪色检验乙烯,所以①为A;②为B;③为A;④为D,
故答案为:A;B;A;D;
(5)装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,
故答案为:品红溶液褪色;
(6)装置③试管通过品红溶液不褪色确认SO2已除干净,
故答案为:验证二氧化硫已除净;
(7)装置③中品红溶液不褪色,证明二氧化硫已经除尽,装置④中高锰酸钾酸性溶液褪色,则证明产生的气体中含有乙烯,
故答案为:装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色‘
(8)乙醇在浓硫酸存在条件下加热到140℃左右会发生分子间脱水生成乙醚:C2H5-O-C2H5,
故答案为:C2H5-O-C2H5.
点评 本题考查了浓硫酸的性质、乙酸乙酯的制取,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,注意掌握浓硫酸的性质,明确乙酸乙酯的制取原理及常见气体的检验方法.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{5}$mol | B. | $\frac{2}{5}$ mol | C. | $\frac{3}{5}$mol | D. | $\frac{11}{5}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.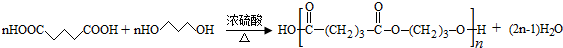 ;
; (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
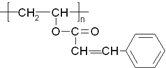 光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )| A. | 合成此高聚物的单体的化学式为C11H10O2 | |
| B. | 发生加成反应时1 mol该物质可消耗4molH2 | |
| C. | 该物质可稳定存在于碱性溶液中 | |
| D. | 该物质可经过缩聚反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| B. | 福尔马林用于制备标本是利用了其使蛋白质变性的性质 | |
| C. | 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 | |
| D. | 做衣服的棉和麻均与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 常温常压下,2.3gNa+中含有的电子数为NA | |
| C. | 标准状况下,11.2L臭氧含有的氧原子数为NA | |
| D. | 0.1 mol•L-1Na2CO3溶液中含有的钠离子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com