
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
分析 金属元素和非金属元素的区别是:金属元素的原子最外层电子数<4(氢和氦除外),且金属元素的原子易失电子形成阳离子;而非金属元素的原子一般最外层电子数≥4,且非金属元素的原子易得电子形成阴离子.
解答 解:A.氢易失去电子,但属于非金属元素,故A错误;
B.原子核外有10个电子的微粒,为Ne,是非金属元素,不是金属元素,故B错误;
C.最外层只有一个电子的元素如氢元素,属于非金属元素,故C错误;
D.原子核内有12个质子的元素是Mg,最外层有2个电子,Mg是金属元素,故D正确;
故选D.
点评 本题考查的是金属元素和非金属元素的区别,其实判断二者的简单方法还是最外层电子数,但是只要把氢氦这两个特殊情况记住即可,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 反应Ⅰ | 反应Ⅱ |
| A | 甲烷与氯气在光照下生产一氯甲烷 | 乙烯与溴的四氯化碳溶液反应 |
| B | 乙醇催化氧化生成乙醛 | 由淀粉得到葡萄糖 |
| C | 由油脂得到甘油 | 乙烯制备聚乙烯 |
| D | 苯与浓硫酸浓硝酸反应生成硝基苯 | 乙醇和乙酸反应制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;I的分子式是C8H6O3.
;I的分子式是C8H6O3.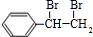 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$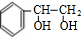 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.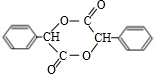 .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Mg2+、Al3+ | B. | Mg2+、Al3+、Cu2+ | C. | Fe3+、Cu2+、Zn2+ | D. | Ag+、Cu2+、Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com