
从物质A的水溶液出发,有如图所示的一系列变化(参加反应或反应生成的H2O没有表示出来)。
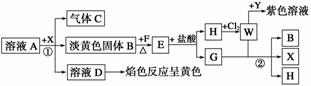
试完成下列问题:
(1)写出下列物质的化学式:
A________,E________,X________,Y________。
(2)写出步骤①②发生反应的离子方程式:
①________________________________________________________________________;
②________________________________________________________________________。
答案 (1)Na2S2O3 FeS HCl C6H5OH
(2)①S2O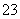 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
②2Fe3++H2S===2Fe2++S↓+2H+
解析 分析“H+Cl2—→W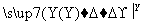 紫色溶液”,可知“H+Cl2—→W”为化合反应,并且考虑到三价铁离子遇苯酚溶液显紫色。联想到常见的反应:2FeCl2+Cl2===2FeCl3,可知H为FeCl2,W为FeCl3,Y为苯酚。由G+W(FeCl3)—→B(淡黄色固体)+X+H(FeCl2)知,G为还原剂,固体B为反应后的生成物,可联想到H2S与FeCl3的反应,从而断定G为H2S,B为S,X为HCl。“B+F
紫色溶液”,可知“H+Cl2—→W”为化合反应,并且考虑到三价铁离子遇苯酚溶液显紫色。联想到常见的反应:2FeCl2+Cl2===2FeCl3,可知H为FeCl2,W为FeCl3,Y为苯酚。由G+W(FeCl3)—→B(淡黄色固体)+X+H(FeCl2)知,G为还原剂,固体B为反应后的生成物,可联想到H2S与FeCl3的反应,从而断定G为H2S,B为S,X为HCl。“B+F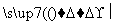 E
E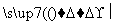 H(FeCl2)+
H(FeCl2)+ G(H2S)”中的F为Fe,E为FeS。“A+X(HCl)
G(H2S)”中的F为Fe,E为FeS。“A+X(HCl) —→B+C(气体)+D”中的A为Na2S2O3,C为SO2,D为NaCl。反应①的离子方程式为S2O
—→B+C(气体)+D”中的A为Na2S2O3,C为SO2,D为NaCl。反应①的离子方程式为S2O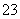 +2H+===S↓+SO2↑+H2O,反应②的离子方程式为
+2H+===S↓+SO2↑+H2O,反应②的离子方程式为
2Fe3++H2S===2Fe2++S↓+2H+。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO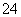 、NO
、NO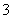
B.可用稀硝酸除去试管内壁上的银镜
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO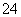
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.Cu(OH)2中加入硫酸:OH-+H+===H2O
B.钠加入水中:Na+2H2O===Na++2OH-+H2↑
C. FeSO2溶液中加入稀硝酸:3Fe2++4H++NO ===3Fe3++2H2O+NO↑
===3Fe3++2H2O+NO↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式如右图所示,下列关于该物质的性质描述正确的是
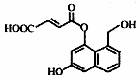 A.不能使溴的四氯化碳溶液褪色
A.不能使溴的四氯化碳溶液褪色
B.能发生缩聚反应
C.既能发生消去反应,也能发生取代反应
D.1 mol该物质最多可与5mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
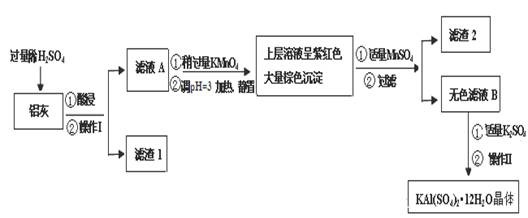 明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnS04发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关物质存在如图所示的转化关系(部分产物已略去)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。

请回答下列问题:
(1)反应①的化学方程式为_________________________________________________
________________________________________________________________________。
(2)反应②的离子方程式为__________________________________________________
[
________________________________________________________________________。
(3)写出另外一种实验室制取H的化学方程式:_______________________________
________________________________________________________________________。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2 m ol·L-1,则生成沉淀所需Pb(NO3)2溶液的最
ol·L-1,则生成沉淀所需Pb(NO3)2溶液的最 小浓度为______________。
小浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物 ( )
A.所含共用电子对数目为(a/7+1)NA
B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6a/14 L
D.所含原子总数为aNA/14
查看答案和解析>>
科目:高中化学 来源: 题型:
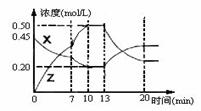
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
 bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是
A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
B.化学方程式中a:b= 1:3,
C.推测在第7min时曲线变化的原因可能是增加X的浓度
D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com