
检验SO2气体中是否存在CO2气体,应采用的方法是( )
通过澄清石灰水
先通过小苏打(NaHCO3)溶液,再通过石灰水
先通过足量酸性高锰酸钾溶液,再通过石灰水
通过品红溶液
科目:高中化学 来源: 题型:
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.X2-的还原性一定大于Y-
B.由mXa+与nYb-得m+a=n-b
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性一定是X大于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们
的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的
预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是 (  )
)
A.X单质不易与水反应
B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高
D.XH4的稳定性比SiH4的高
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯水加热至90℃时,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.(12分)现有下列物质:①HNO3 ②冰醋酸 ③氨水 ④Al(OH)3 ⑤NaHCO3(s) ⑥Cu ⑦氯水 ⑧CaCO3 ⑨H2CO3 ⑩盐酸
(1)上述物质中属于强电解质的有________,属于弱电解质的有________。
(2)写出下列物质的电离方程式:
②、______________________;④、______________________;
⑤、______________________;⑨、 。
Ⅱ.(4分)化学反应4A(s)+3B(g)  2C(g)+D(g)经10 minC的浓度增加0.6 mol/L。
2C(g)+D(g)经10 minC的浓度增加0.6 mol/L。
(1)用B表示的反应速率是________ 。
(2)分别用B、C、D表示的反应速率其比值是________ 。
Ⅲ.(8分)完成下列问题:
(1)汽油的重要成分是辛烷(C8H18),1molC8H18(l)在与O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518KJ热量,该反应热化学方程式为:
。
(2)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石、s)+O2(g)=CO2(g) △H=-395.41kJ/mol
C(石墨、s)+O2(g)=CO2(g) △H=-393.51kJ/mol
则石墨转化为金刚石的热化学方程式为:________ ,由此看来金刚石的稳定性 (填“大于”、“小于”、“不确定”)石墨的稳定性。
(3)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应。已知:
N2(g) +2O2(g) =2NO2(g) ⊿H=67.7kJ/mol
N2H4(g) +O2(g) = N2(g) +2H2O(g) ⊿H=-534kJ/mol
H2 O (l) =H2O (g) ΔH=44 kJ/mol
1molN2H4(g)与 NO2(g)完全反应生成N2和H2 O (l)时放出热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是 ( )
A.稀HNO3和金属反应时主要得到氢气
B.NH3易液化,液氨常用作制冷剂
C.利用氨气极易溶于水,氨气可以做喷泉实验
D.铵盐受热易分解,贮存氨态氮肥时要密封保存,并放在阴凉通风处
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A、在周期表中,族序数都等于该族元素的最外层电子数
B、非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
C、同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大
D、碱金属随原子序数的增大,其熔沸点逐渐降低;卤素单质随原子序数的增大,其熔沸点逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关。下列说法不正确的是
A.食盐可作调味剂,也可作食品防腐剂
B.小苏打是一种膨松剂,可用于制作馒头和面包
C.煤经过气化和液化等物理变化可以转化为清洁燃料
D.次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛
的Ca(NO2)2,其部分工艺流程如下:
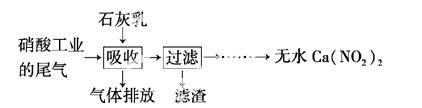
(1)一定条件下,NO 与NO2存在下列反应:NO(g)+NO2(g) N2O3(g),其平衡常数表达式为K= 。
N2O3(g),其平衡常数表达式为K= 。
(2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目是 ;
滤渣可循环使用,滤渣的主要成分是 (填化学式)。
(3)该工艺需控制NO 和NO2物质的量之比接近1∶`1。若n(NO)∶n(NO 2)>1∶1,则会导致 ;若n(NO)∶n(NO2)<1∶1,则会导致 。
2)>1∶1,则会导致 ;若n(NO)∶n(NO2)<1∶1,则会导致 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式__ _________________________
_________________________ ______________________。
______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com