
【题目】表中是元素周期表的一部分,回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①_______,⑥_______,⑦_______,_________。
(2)在这些元素形成的单质中,最活泼的金属单质是_____________,最活泼的非金属单质是_________(用化学符号做答)。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)____________,碱性最强的是____________,呈两性的是___________,以上三者之间相互反应的化学方程式:________________________;________________________;________________________
(4)在④与⑤形成的单质中,化学性质较活泼的是____________(填名称),设计两个原理不同的简单实验。
方案一:________________________________________________;
方案二:________________________________________________。
(5)在⑦与⑧形成的单质中,化学性质较活泼的是____________,写出可以证明该结论的一个离子反应方程式________________________。
【答案】N ![]() S
S ![]() K
K ![]()
![]()
![]()
![]()
![]()
![]()
![]() 镁 用
镁 用![]() 条和
条和![]() 片分别和同浓度的盐酸反应,观察其反应速率的快慢 分别向
片分别和同浓度的盐酸反应,观察其反应速率的快慢 分别向![]() 溶液、
溶液、![]() 溶液中加入
溶液中加入![]() 溶液,观察其沉淀及其溶解情况 氯气 Cl2+2H2S=2H++2Cl-+S↓
溶液,观察其沉淀及其溶解情况 氯气 Cl2+2H2S=2H++2Cl-+S↓
【解析】
由元素在周期表中位置可知,①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦S、⑧为Cl、⑨为Ar、⑩为K、为Ca、为Br,结合元素周期律分析解答。
(1)由元素在周期表中位置可知,①、⑥、⑦、分别为N、Si、S、Ca,故答案为:N;Si;S;Ca;
(2)同周期自左而右,金属性减弱、非金属性增强,同主族自上而下,金属性增强、非金属性减弱,故上述元素中最活泼的金属元素是⑩,为K元素;最活泼的非金属元素是②,为F元素,故答案为:K;F2;
(3)非金属性越强,最高价含氧酸的酸性越强,F元素没有最高价含氧酸,故HClO4的酸性最强;金属性越强,最高价氧化物对应水化物的碱性越强,故KOH的碱性最强;Al(OH)3是两性氢氧化物,以上三者之间相互反应的化学方程式为:![]() 、
、![]() 、
、![]() ,故答案为:HClO4;KOH;Al(OH)3;
,故答案为:HClO4;KOH;Al(OH)3;![]() ;
;![]() ;
;![]() ;
;
(4)在④与⑤形成的单质中,化学性质较活泼的是镁,要验证该结论可以通过二者单质分别与水反应的剧烈程度来判断,也可以根据氢氧化镁和氢氧化铝的碱性强弱来判断,因此方案一:用镁条和铝片分别和同浓度的盐酸反应,观察其反应速率的快慢,方案二:分别向AlCl3溶液、氯化镁溶液中加入NaOH溶液,观察其沉淀及其溶解情况,故答案为:镁;用镁条和铝片分别和同浓度的盐酸反应,观察其反应速率的快慢;分别向AlCl3溶液、氯化镁溶液中加入NaOH溶液,观察其沉淀及其溶解情况;
(5)⑧和⑦分别是Cl和S,根据同周期元素非金属性的递变规律可知,非金属性Cl>S,根据判断非金属性强弱的方法,可依据二者气态氢化物的稳定性、单质之间的置换反应等来判断其非金属性强弱,因此可以证明该结论的一个离子反应方程式可以为Cl2+2H2S=2HCl+S↓,故答案为:氯气;Cl2+2H2S=2H++2Cl-+S↓。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
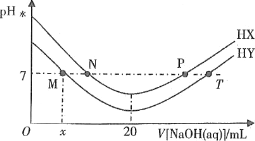
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙胺卡因(H)是一种局部麻醉药物,实验室制备H的一种合成路线如下:

已知:![]()
![]()
 (R和R'为烃基或H)
(R和R'为烃基或H)
回答下列问题:
(1)B的化学名称是___________,H的分子式是____________。
(2)C中所含官能团的名称为_______________,由G生成H的反应类型是___________。
(3)C与F反应生成G的化学方程式为___________。反应中使用K2CO3的作用是_______。
(4)化合物X是E的同分异构体,X能与NaOH溶液反应,其核磁共振氢谱只有1组峰。X的结构简式为________。
(5) (聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮(CH3COCH3)和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线___________。(无机试剂任选)
(聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮(CH3COCH3)和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线___________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将![]() 溶液用
溶液用![]() 盐酸滴定时,若用酚酞做指示剂,终点时消耗盐酸
盐酸滴定时,若用酚酞做指示剂,终点时消耗盐酸![]() ;若用甲基橙做指示剂,终点时消耗盐酸
;若用甲基橙做指示剂,终点时消耗盐酸![]() 。现有一份白色粉末,可能含有
。现有一份白色粉末,可能含有![]() 、
、![]() 、
、![]() 的一种或两种。现取一定量的该粉未配成适当浓度的稀溶液并分成两等份,分别用
的一种或两种。现取一定量的该粉未配成适当浓度的稀溶液并分成两等份,分别用![]() 盐酸滴定。一份用酚酞做指示剂,消耗盐酸
盐酸滴定。一份用酚酞做指示剂,消耗盐酸![]() ;另一份用甲基橙做指示剂,消耗盐酸
;另一份用甲基橙做指示剂,消耗盐酸![]() 。下列说法正确的是( )
。下列说法正确的是( )
①若![]() ,则固体中只含有
,则固体中只含有![]()
②若![]() ,则固体中只含
,则固体中只含![]()
③若![]() ,则固体中含有
,则固体中含有![]() 、
、![]()
④若![]() ,则固体中含有
,则固体中含有![]() 、
、![]()
A.①②③④B.③④C.①②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定含少量![]() 的小苏打固态样品中
的小苏打固态样品中![]() 的质量分数可采用以下四种方法。
的质量分数可采用以下四种方法。
方法一: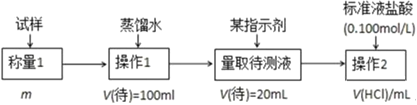
方法二: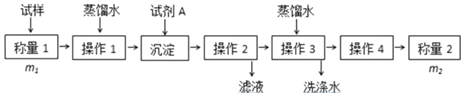
方法三: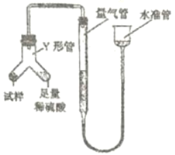
方法四:不使用化学试剂,使用实验室常用仅器。
按要求回答下列问题:
(1)方法一的操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要____________、____________;操作2的名称是____________该过程选择的指示剂是____________;该样品中![]() 的质量分数为____________[用如图数据填写含m、
的质量分数为____________[用如图数据填写含m、![]() )的表达式]。
)的表达式]。
(2)方法二中需要加入试剂A将![]() 离子转化为沉淀并称重。为提高实验的精度,在下列供选试剂中,试剂A的最佳选择为____________(填编号)。
离子转化为沉淀并称重。为提高实验的精度,在下列供选试剂中,试剂A的最佳选择为____________(填编号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
该方法中操作2的名称是____________;操作3的名称是____________;如何判断操作3目的己经达到:________________________。方法二中需要用到的定量仪器为____________。
(3)方法三中实验装置,如何检验装置气密性:________________________;装置中使用Y型管的优点是________________________;若实验中读数时量气管中液面位置如图所示,则测定结果将____________(填写“偏大”、“偏小”或“无影响”),如有影响应该如何调整?____________(若认为无影响可不回答此题)
(4)方法四的实验原理是____________(用化学方程式表示),实验中需测定的实验数据是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应可用于检测司机是否酒后驾驶:![]()
![]() 。
。
①配合物![]() 中,与
中,与![]() 形成配位键的原子是__________(填元素符号)。
形成配位键的原子是__________(填元素符号)。
②![]() 中
中![]() 原子的杂化轨道类型是________;
原子的杂化轨道类型是________;![]()
![]() 含有
含有![]() 键的数目为_______。
键的数目为_______。
(2)![]() 分子中,
分子中,![]() 原子的杂化轨道类型是__________;写出由3个原子组成且与
原子的杂化轨道类型是__________;写出由3个原子组成且与![]() 具有相同空间构型的离子:___________(填一个即可)。
具有相同空间构型的离子:___________(填一个即可)。
(3)石墨烯(结构如图1所示)是一种由单层碳原子构成的具有平面结构的新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(结构如图2所示)。
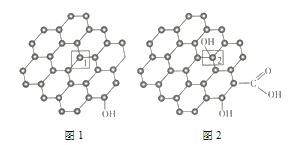
氧化石墨烯中2号![]() 原子的杂化方式是_________,该
原子的杂化方式是_________,该![]() 原子与相邻
原子与相邻![]() 原子形成的键角______(填“>”“<”或“=”)石墨烯中1号
原子形成的键角______(填“>”“<”或“=”)石墨烯中1号![]() 与相邻
与相邻![]() 形成的键角。
形成的键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐![]() (用
(用![]() 代表)。回答下列问题:
代表)。回答下列问题:
(1)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(![]() )。第二周期部分元素的
)。第二周期部分元素的![]() 变化趋势如图(a)所示,其中除氮元素外,其他元素的
变化趋势如图(a)所示,其中除氮元素外,其他元素的![]() 自左而右依次增大的原因是__________;氮元素的
自左而右依次增大的原因是__________;氮元素的![]() 呈现异常的原因是_________。
呈现异常的原因是_________。
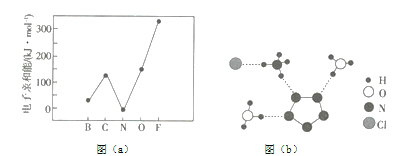
(2)经![]() 射线衍射测得化合物
射线衍射测得化合物![]() 的晶体结构,其局部结构如图(b)所示。
的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,![]() 中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
A 中心原子的杂化轨道类型 B 中心原子的价层电子对数
C 立体结构 D 共价键类型
②![]() 中阴离子
中阴离子![]() 中的键总数为__________个。分子中的大
中的键总数为__________个。分子中的大![]() 键可用符号表示
键可用符号表示![]() ,其中
,其中![]() 代表参与形成大
代表参与形成大![]() 键的原子数,
键的原子数,![]() 代表参与形成大
代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() )则
)则![]() 中的大
中的大![]() 键应表示为__________。
键应表示为__________。
③图(b)中虚线代表氢键,其表示式为![]() 、__________、__________。
、__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,有关合成路线图如下:
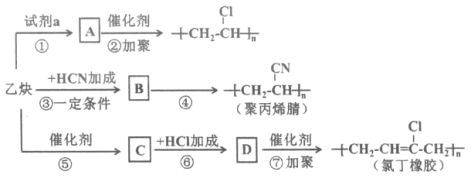
已知: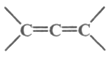 不稳定
不稳定
(1)乙炔中官能团的名称是__________。
(2)试剂a是__________。
(3)写出物质B的结构简式__________。
(4)④的反应类型是__________。
(5)写出下列反应的化学方程式:反应⑤_______;反应⑦_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com