
下列离子方程式正确的是( )
A. 向盐酸中滴加氨水:H+ + OH- = H2O
B. Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C. 铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D.  溶液与
溶液与 溶液混合:
溶液混合: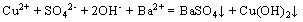
科目:高中化学 来源: 题型:
某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:

(1) 将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①.氯元素在周期表中的位置为 。
②.A中反应的离子方程式:___ _。
③.E中氢氧化钠溶液的作用__________ 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
④.实验Ⅰ推出的相应结论是否合理? _________,若不合理,请说明理由(若合理,无需填写)________________________________ ______________。
⑤.实验Ⅱ推出相应的结论是否合理?_________,若不合理,请说明理由(若合理,无需填写)____________________________________ ____________________。
(2) 为比较Cl2和I2的氧化性强弱,将A、C、E相连, C中盛的试剂可以为___ _ __。
(3) 将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①.B中反应的化学方程式_____________________ ______ __________。
②.先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b ,微热试管丁, 丁中可观察到的实验现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图装置可用来监测空气中NO的含量,下列说法正确的是( )
A.电子由Pt电极流出,经外电路流向NiO电极
B.Pt电极上发生的是氧化反应
C.NiO电极的电极反应式为NO+O2——2e— = NO2
D.每流经l m3空气(假设NO被完全吸收),转移电子的物质的量为2 ×l0-7mol,则该空气中NO的含量约为3×10-2mg/m3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①植物油和裂化汽油都可以使溴水褪色 ②葡萄糖、油脂和蛋白质都能发生水解反应
③可用碳酸氢钠溶液鉴别乙酸和乙醇 ④防腐剂福尔马林(含HCHO)可用作食品保鲜剂
⑤乙醇、乙酸、乙酸乙酯都能发生取代反应
A.①③⑤ B.①②⑤ C.②④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸二甲酯(DMC)是一种新型的绿色有机合成中间体,其在生产中具有使用安全、方便、污染少、容易运输等特点。已知一定条件下,碳酸二甲酯能发生如下反应:
反应①:
反应②:
(1)化合物Ⅲ的分子式为 ,反应①和反应②中R的结构简式为 。
(2)DMC与足量NaOH溶液反应的化学方程式 。
(3)类似于反应①,DMC与乙酸苯酯( )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是 。
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是 。
A.G的名称是甲酸乙酯 B.丙酸和G互为同分异构体
C.一定条件下,G能发生水解反应 D.G能与新制Cu(OH)2反应生成红色沉淀
(4)反应①中反应物用量不同,可得到化合物H( ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体 。
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体 。
A.遇FeCl3溶液显紫色,B.苯环上的核磁共振氢谱有两组峰,C.能发生银镜反应
(5)以碳酸二甲酯合成杀虫剂西维因的路线如下:
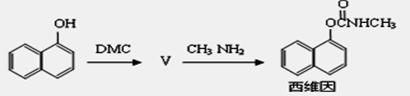
其中生成物Ⅴ的反应类似于反应②,则Ⅴ的结构简式为 ,1mol西维因最多可与 mol H2发生加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是 ( )
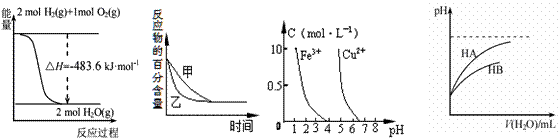 |
图1 图2 图3 图4
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图3,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH=4,过滤
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)  N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A | B |
|
|
|
| 升高温度,平衡常数减小 | 0~3 s内,反应速率为 v(NO2)=0.2 mol·L-1 |
| C | D |
|
|
|
| t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
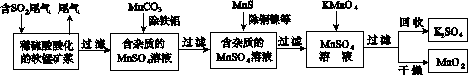
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原因是________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化方程式是____________________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com