
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答。
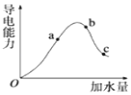
①a、b、c三点的氢离子浓度由小到大的顺序为______。
②a、b、c三点中,醋酸的电离程度最大的一点是______。
③测得某醋酸溶液中氢离子浓度为0.004molL﹣1,则醋酸的电离度为_____,该温度下醋酸的电离平衡常数K=_____。
【答案】c<a<b c 4% 1.6×10-5
【解析】
本题考查的是弱电解质在水溶液中的电离平衡。
①溶液的导电能力与离子浓度成正比;
②溶液越稀,醋酸的电离程度越大;
③电离度=已电离的醋酸/醋酸的总浓度×100%;醋酸的电离常数为Ka=c(CH3COO)c(H+)/c(CH3COOH)。据此解答。
①溶液的导电能力与离子浓度成正比,根据图象知,溶液导电能力大小顺序是b>a>c,则氢离子浓度由小到大顺序是c<a<b。本小题答案为:c<a<b。
②溶液越稀,醋酸的电离程度越大,根据图象知,溶液体积大小顺序是c>b>a,所以醋酸电离程度最大的是c。本小题答案为:c。
③醋酸溶液中氢离子浓度为0.004molL1,则醋酸的电离度=已电离的醋酸/醋酸的总浓度×100%=0.004/0.1×100%=4%
醋酸的电离常数为Ka=c(CH3COO)c(H+)/c(CH3COOH)=0.004×0.004/(0.10.004)=1.6×105。本小题答案为:4%;1.6×105。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中前三周期的主族元素,它们的原子序数按A、B、C、D、E的顺序增大。A的最外层电子数是次外层电子数的2倍,C与E最外层电子数相等,E的最高价氧化物中含氧60%,D与C可形成D2C、D2C2两种离子化合物。填写下列空白:
(1)写出上述五种元素的元素符号:A___,B___,C___,D____,E___。
(2)写出D2C2的电子式_________,AC2的结构式___________。
(3)用电子式表示 AC2化合物的形成过程__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH![]() +3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
+3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性:NH4+>Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,日常生活中,将洁厕液与84消毒液混合使用会发生中毒的事故。
(1)84消毒液的主要成分是次氯酸钠,次氯酸钠与空气中CO2反应生成次氯酸,写出次氯酸钠的电子式:__________;若将84消毒液长期露置于空气中,溶液中的主要成分将变为__________(填化学式)。
(2)洁厕灵的主要成分是HCl。洁厕液与84消毒液混合后会发生氧化还原反应,生成有毒的氯气。写出该反应的离子方程式:______________________________。
(3)下列氧化还原反应中,与上述反应类型不同的是________。
A.Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O B.2FeCl3+Fe===3FeCl2
C.S+2H2SO4(浓)![]() 3SO2↑+2H2O D.KClO3+5KCl+3H2SO4===3K2SO4+3Cl2↑+3H2O
3SO2↑+2H2O D.KClO3+5KCl+3H2SO4===3K2SO4+3Cl2↑+3H2O
II.已知高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液可以发生氧化还原反应。请回答下列问题:
(1)该反应中的还原剂是________(填化学式)。
(2)写出该反应的离子方程式:____________________________________________。
(3)若生成1molCO2则转移电子_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒半径大小比较正确的是
A. Na<Mg<Al<S B. I<Br<Cl<F
C. Na+<Mg2+<Al3+<O2- D. S2->Cl->Na+>Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出以下物质的电子式:Na2O2__________H2S___________
(2)用“>”或“<”回答下列问题:
酸性:H2SiO3____H3PO4;稳定性:HCl____CH4;氧化性:Cu2+_____Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
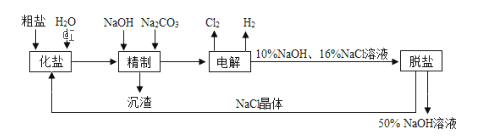
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的离子方程式是________,________.
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ ,该钡试剂可以是____
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(3)电解过程中所发生反应的化学方程式为________,与电源正极相连的电极附近产生的气体是________,检验该气体可使用的试纸及现象是.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:
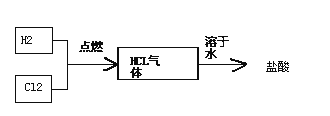
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是________.合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97%________.
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为________.
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显________色,往B试管中通入干燥的氯化氢气体,试纸显________色.最后向C试管中加入物质________(填化学式),他之所以加入这种物质的理由是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com