
下列物质中含有原子数由多到少排列正确的是( )
①0.1molH2SO4 ②4.8g氦气 ③5.6L标况下NH3(气)④4℃时的5.4mLH2O
A.①②③④ B.④③②① C.②③④① D.②④③①
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式:
(ⅰ)I2(g)+H2(g)  2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)  2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做乙醛还原性的实验,取1 mol·L-1的硫酸铜溶液2 mL和0.4 mol·L-1的氢氧化钠溶液4 mL,在一个试管里混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无砖红色沉淀,实验失败的原因是( )
A.氢氧化钠的量不够 B.硫酸铜的量不够
C.乙醛溶液太少 D.加热时间不够
查看答案和解析>>
科目:高中化学 来源: 题型:
解析:(1)利用“N”守恒可知需m(NaN3)= ×
× ×65 g·mol-1=78 g。
×65 g·mol-1=78 g。
(2)①由反应方程式可知产生1 mol H2同时生产2 mol OH-,故c(OH-)= =0.75 mol/L;②设合金中Na、K的物质的量分别为a mol、b mol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2和23a+39b=5.05,解得a=0.050 mol、b=0.10 mol,故可得到合金的化学式为NaK2。
=0.75 mol/L;②设合金中Na、K的物质的量分别为a mol、b mol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2和23a+39b=5.05,解得a=0.050 mol、b=0.10 mol,故可得到合金的化学式为NaK2。
(3)若溶液仅含NaAl(OH)4,利用方程式可知得到24 mol Al(OH)3的同时生成12 mol Na2CO3,而实际得到24 mol Al(OH)3 与15 mol Na2CO3,说明溶液中含有NaOH,且NaOH优先与CO2反应生成Na2CO3,利用Na守恒知溶液中n(NaOH)=(15-12) mol×2=6 mol,故通入 112 L (5 mol)CO2先与NaOH作用消耗3 mol CO2生成3 mol Na2CO3,然后2 mol CO2与NaAl(OH)4作用得到4 mol Al(OH)3和2 mol Na2CO3,故n[Al(OH)3]∶n(Na2CO3)=4∶(3+2)=4∶5。
(4)由NaOH+HCl===NaCl+H2O可知溶液pH=7时,二者恰好反应完全,故三次实验得到的固体均为纯净氯化钠,利用“钠守恒”得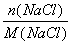 =
= ,利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
,利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
答案:(1)78 (2)①c(OH-)= ×1 000=0.75 (mol/L)
×1 000=0.75 (mol/L)
②设上述合金中含a mol钠、b mol钾,则
a=0.050 b=0.10
该钠—钾合金的化学式为NaK2。
(3)溶液含氢氧化钠。氢氧化钠和二氧化碳反应生成碳酸钠:15-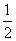 ×24=3 (mol)
×24=3 (mol)
112 L二氧化碳的物质的量: =5 (mol)
=5 (mol)
n[Al(OH)3]∶(Na2CO3)=[(5-3)×2]∶5=4∶5
(4)由氯化钠的质量推算,氢氧化钠样品的摩尔质量为
M1(氢氧化钠)= ×2.40=40 (g/mol)
×2.40=40 (g/mol)
M2(氢氧化钠)=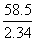 ×2.32=58 (g/mol)
×2.32=58 (g/mol)
M3(氢氧化钠)= ×3.48=58 (g/mol)
×3.48=58 (g/mol)
结论:
实验①所取氢氧化钠样品是NaOH;
实验②和实验③所取氢氧化钠样品应该是NaOH·H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是______________________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成。进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a的目的是_____________________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是______________________
________________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象iii中黄绿色褪去的原因:__________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是( )
A. Na+、Ag+、CO32-、Cl- B. K+、 Ba2+、 SO42-、Cl-
C. Na+、K+、CO32-、Cl- D. Na+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是( )
A.1:3 B.2:3 C.1:1 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
将两金属A、B分别用导线相连接,并同时插入电解质溶液中,发现A极的质量增加,则下列说法正确的是
A.金属活动性:A>B
B.A极是正极,电解质溶液可以是盐酸
C.B极是负极
D.要判断A极与B极是正极还是负极,还需考虑电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中两个的反应,均可用同一离子方程式表示的是( )
A.CH3COOH溶液和Na2CO3溶液与CH3COOH溶液和NaHCO3溶液
B.CaCO3和HCl溶液与Na2CO3和HCl溶液
C.BaCl2溶液和Na2SO4溶液与Ba(OH)2溶液与H2SO4溶液
D.KOH溶液和CH3COONH4溶液与Ba(OH)2溶液与NH4Cl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com