
【题目】下列叙述中正确的是( )
A.氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3?H2O═Al(OH)3↓+3NH ![]()
B.存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答: 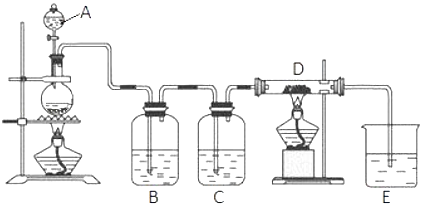
(1)烧瓶中反应的化学方程式是 .
(2)装置B中盛放液体是 , 气体通过装置B的目的是 . 装置C中盛放的液体是 , 气体通过装置C的目的是 .
(3)烧杯E中盛放的液体是 .
(4)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加装置.
(5)当电子转移的数目为6.02×1023个时生成的氯气的物质的量为mol,生成的氯气用0.5mol/L的NaOH溶液L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验. 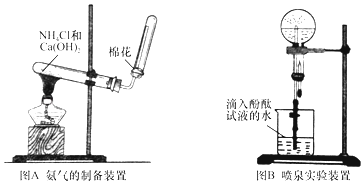
(1)根据图A写出实验室制取氨气的化学方程式;
(2)收集氨时,试管口棉花的作用;验满的方法是;收集干燥的氨时,使用的干燥剂是;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是 .
A.氢气
B.氧气
C.氯气
D.二氧化碳
(4)图B装置进行喷泉实验,烧瓶中充满氨气,引发水上喷的操作是;所得溶液呈性(填酸性、碱性或中性),解释原因(用化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图1和图2所示,请将数据填入表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取七水合硫酸亚铁(FeSO47H2O),设计了如图流程:下列说法不正确的是( ) 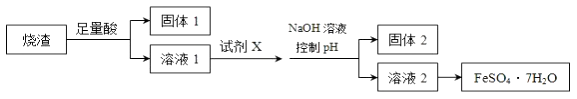
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH为使Al3+转化为Al(OH)3 , 进入固体2
C.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生。则下列结论正确的是
A. 滤液中一定有Fe(NO3)3
B. 滤渣只含Ag和Cu,一定无Zn
C. 滤渣中一定有Ag、Cu和Fe,一定无Zn
D. 滤渣中一定有Ag、Cu、Fe和Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿的主要成分是CuFeS2(硫元素﹣2价,铁元素+2价).实验室用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如图: 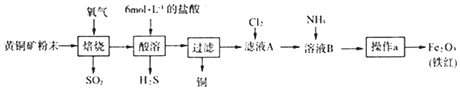
已知:CuFeS2+O2 ![]() Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
Cu+FeS+SO2 FeS+2HCl=FeCl2+H2S↑
(1)实验室制氯气的化学方程式为 .
(2)SO2和H2S有毒,会造成大气污染.
①已知SO2和H2S混合可以得到单质硫.为使SO2和H2S恰好完全转化为硫,二者体积(标准状况)比应为 .
为检验某尾气中是否含有SO2、CO2、CO三种气体,实验小组同学用如下装置设计实验.
选择上述装置(可以重复),按照气流方向其连接顺序为A→(填序号).
(3)PbO2具有强氧化性,可与浓盐酸反应制取氯气.
①上述反应化学方程式为;由PbO与次氯酸钠溶液反应可制得PbO2 , 反应的离子方程式为 .
②Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.Na2S2O3在溶液中被Cl2氧化成SO42﹣ , 则该反应的化学方程式为 .
③本实验存在的一个缺陷是 .
(4)按上述流程用150g黄铜矿粉末可制得48gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是(假设各步反应均完全进行且过程中无额外物质损耗).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com