
ЁОЬтФПЁПвЛЖЈЬѕМўЯТНјааЗДгІЃКCOCl2(g) ![]() Cl2(g)ЃЋCO(g)ЃЌЯђ2.0 LКуШнУмБеШнЦїжаГфШы1.0 mol COCl2(g)ЃЌЗДгІЙ§ГЬжаВтЕУЕФгаЙиЪ§ОнМћЯТБэЃК
Cl2(g)ЃЋCO(g)ЃЌЯђ2.0 LКуШнУмБеШнЦїжаГфШы1.0 mol COCl2(g)ЃЌЗДгІЙ§ГЬжаВтЕУЕФгаЙиЪ§ОнМћЯТБэЃК
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )
A. ЪЙгУЧЁЕБЕФДпЛЏМСФмМгПьИУЗДгІЫйТЪ
B. ИУЬѕМўЯТЃЌCOCl2ЕФзюДѓзЊЛЏТЪЮЊ60%
C. 6sЪБЃЌЗДгІДяЕНзюДѓЯоЖШМДЛЏбЇЦНКтзДЬЌ
D. ЩњГЩCl2ЕФЦНОљЗДгІЫйТЪЃЌ0ЁЋ2sБШ2ЁЋ4sПь
ЁОД№АИЁПB
ЁОНтЮіЁПA. ЪЙгУЧЁЕБЕФДпЛЏМСФмМгПьИУЗДгІЫйТЪЃЌAе§ШЗЃЛB. ИУЬѕМўЯТЦНКтЪБЩњГЩТШЦј0.4molЃЌЯћКФCOCl20.4molЃЌЫљвдCOCl2ЕФзюДѓзЊЛЏТЪЮЊ40%ЃЌBДэЮѓЃЛC. 6sЪБТШЦјЕФХЈЖШВЛдйЗЂЩњБфЛЏЃЌЗДгІДяЕНзюДѓЯоЖШМДЛЏбЇЦНКтзДЬЌЃЌCе§ШЗЃЛD. 0ЁЋ2sКЭ2ЁЋ4sЩњГЩТШЦјЕФЮяжЪЕФСПЗжБ№ЪЧ0.3molЁЂ0.09molЃЌвђДЫЩњГЩCl2ЕФЦНОљЗДгІЫйТЪЃЌ0ЁЋ2sБШ2ЁЋ4sПьЃЌDе§ШЗЃЌД№АИбЁBЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаТжЦТШЫЎжаКЌгаЖржжСЃзгЃЌФГаЃЛЏбЇбаОПадбЇЯАаЁзщЕФЭЌбЇЮЊЬНОПЦфаджЪЃЌзіСЫШчЯТЪЕбщЃЌЧыФуАяжњЭъГЩЃК
ЃЈ1ЃЉHClOВЛЮШЖЈЃЌМћЙтвзЗжНтЩњГЩHClКЭO2ЁЃЧыЩшМЦЪЕбщжЄУїгаO2ЩњГЩ_____________________ЁЃ
ЃЈ2ЃЉТШЦјФмЪЙЪЊШѓЕФКьЩЋВМЬѕЭЪЩЋЁЃЖдгкЪЙКьЩЋВМЬѕЭЪЩЋЕФЮяжЪЃЌЭЌбЇУЧЕФПДЗЈВЛвЛжТЃЌШЯЮЊТШЫЎжаДцдкЕФМИжжСЃзгЖМгаПЩФмЁЃЧыФуЩшМЦЪЕбщЃЌЕУГіе§ШЗНсТлЁЃ
ЬсГіЮЪЬт | ЪеМЏзЪСЯ | ЬсГіМйЩш | бщжЄМйЩш | ЕУГіНсТл |
ТШЫЎжаКЮжжЮяжЪФмЪЙЪЊШѓЕФКьЩЋВМЬѕЭЪЩЋЃП | ЂйТШЦјгаЧПбѕЛЏад ЂкТШЦјгыРфЫЎЗДгІЩњГЩбЮЫсКЭДЮТШЫс ЂлДЮТШЫсгаЧПбѕЛЏад | Ђй________ЁЃ ЂкбЮЫсЪЙВМЬѕЭЪЩЋ Ђл________ЁЃ ЂмH2OЪЙВМЬѕЭЪЩЋ | ЪЕбщЂйЃКАбКьЩЋИЩВМЬѕЗХШыГфТњТШЦјЕФМЏЦјЦПжаЃЌВМЬѕВЛЭЪЩЋЃЛ ЪЕбщЂкЃК_________ЁЃ ЪЕбщЂлЃК_______ЁЃ ЪЕбщЂмЃКАбКьЩЋВМЬѕЗХдкЫЎРяЃЌВМЬѕВЛЭЪЩЋЁЃ | НсТлЃК ________ |
ЃЈ3ЃЉвбжЊЪвЮТЯТЃЌH2CO3![]() HCO3Ѓ+H+Ka1(H2CO3)=4.45ЁС10Ѓ7
HCO3Ѓ+H+Ka1(H2CO3)=4.45ЁС10Ѓ7
HCO3Ѓ![]() CO32Ѓ+H+Ka2(H2CO3)=5.61ЁС10Ѓ11
CO32Ѓ+H+Ka2(H2CO3)=5.61ЁС10Ѓ11
HClO![]() H++ClOЃKa(HClO)=2.95ЁС10Ѓ8
H++ClOЃKa(HClO)=2.95ЁС10Ѓ8
HCN![]() H++CNЃKa(HCN)=5ЁС10Ѓ10
H++CNЃKa(HCN)=5ЁС10Ѓ10
ЩйСПCO2ЭЈШыNaCNШмвКжаЕФЛЏбЇЗНГЬЪН____________________
ЩйСПЕФТШЦјЭЈШыЕНЙ§СПЕФЬМЫсФЦШмвКжаЕФРызгЗНГЬЪН____________________ЃЛ
ЪвЮТЯТЕШХЈЖШЕФa.NaCNШмвК b.NaClOШмвК c.NaHCO3ШмвКЕФpHДгДѓЕНаЁЕФЫГађЪЧ_________________ЃЛ
ЪвЮТЯТ0.05mol/L NaCNШмвКЕФpHЮЊ_________________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌдк2 LУмБеШнЦїФкЃЌЗДгІ2NO2(g)![]() N2O4(g) ІЄHЃНЃ180 kJЁЄmolЃ1ЃЌn(NO2)ЫцЪБМфБфЛЏШчЯТБэЃК
N2O4(g) ІЄHЃНЃ180 kJЁЄmolЃ1ЃЌn(NO2)ЫцЪБМфБфЛЏШчЯТБэЃК
ЪБМф/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
ЃЈ1ЃЉгУNO2БэЪО0ЁЋ2 sФкИУЗДгІЕФЦНОљЫйЖШ___________ЃЎдкЕк5 sЪБЃЌNO2ЕФзЊЛЏТЪЮЊ_____ЁЃИљОнЩЯБэПЩвдПДГіЃЌЫцзХЗДгІНјааЃЌЗДгІЫйТЪж№НЅМѕаЁЃЌЦфдвђЪЧ_____________________ЁЃ
ЃЈ2ЃЉЩЯЪіЗДгІдкЕк3 sКѓДяЕНЦНКтЃЌФмЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ______ЁЃ
aЃЎЕЅЮЛЪБМфФкЃЌЯћКФ2 mol NO2ЕФЭЌЪБЩњГЩ1 molЕФN2O4
bЃЎШнЦїФкбЙЧПБЃГжВЛБф
cЃЎvФц(NO2)ЃН2vе§(N2O4)
dЃЎШнЦїФкУмЖШБЃГжВЛБф
ЃЈ3ЃЉдк2 sФкЃЌИУЗДгІ_______ЃЈЁАЮќЪеЁБЛђЁАЗХГіЁБЃЉ _______ШШСПЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЮяжЪзщГЩЁЂЗжРре§ШЗЕФЪЧЃЈ ЃЉ
A.бЮЫсЁЂСђЫсЁЂЯѕЫсЖМЪЧЧПбѕЛЏадЫс
B.аТжЦТШЫЎЁЂАБЫЎЕФШмжЪЗжБ№ЪЧДЮТШЫсЁЂАБЗжзг
C.ДПМюЁЂЩеМюЕФГЩЗжЗжБ№ЪЧЬМЫсФЦЁЂЧтбѕЛЏФЦ
D.БНЁЂОлБНввЯЉЁЂОлввЯЉЕФзщГЩдЊЫивдМАдЊЫижЪСПБШЯрЕШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнЕчНтжЪдкШмвКжаЕФЕчРыЧщПіЃЌЮвУЧЛЎЗжГіСЫЫсЁЂМюЁЂбЮЃЌЭЈЙ§бЇЯАЮвУЧжЊЕРЫсКЭМюЖМгаЭЈадЃЌЖјбЮЪЧУЛгаЭЈадЕФЃЌЦфБОжЪдвђЪЧЃЈ ЃЉ
A.бЮВЛФмЕчРыГібєРызг
B.бЮВЛФмЕчРыГівѕРызг
C.бЮВЛФмЕчРыГіH+ЛђOHЉ
D.бЮВЛФмЕчРыГіЙВЭЌЕФРызг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщРызгвЛЖЈФмДѓСПЙВДцЕФЪЧЃЈ ЃЉ
A.ФГЮоЩЋЭИУїЕФЫсадШмвКЃКClЉЁЂNa+ЁЂMnO4ЉЁЂSO42Љ
B.ФмЪЙpHЪджНБфЩюРЖЩЋЕФШмвКЃКNa+ЁЂNH4+ЁЂK+ЁЂCO32Љ
C.МгШыЙ§СПNaOHШмвККѓПЩЕУЕНГЮЧхЕФШмвКЃКK+ЁЂBa2+ЁЂHCO3ЉЁЂClЉ
D.ГЃЮТЯТpH=12ЕФШмвКЃКK+ЁЂBa2+ЁЂClЉЁЂNO3Љ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌМИжжФбШмЧтбѕЛЏЮяЕФБЅКЭШмвКжаН№ЪєРызгХЈЖШЕФИКЖдЪ§гыШмвКЕФpHЙиЯЕШчЯТЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
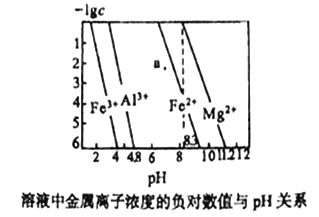
A. aЕуДњБэFe(OH)2БЅКЭШмвК
B. Ksp[Fe(OH)3]< Ksp[Al(OH)3]< Ksp[Fe(OH)2]< Ksp[Mg(OH)2]
C. Яђ0.1mol/L Al3+ЁЂMg2+ЁЂFe2+ЛьКЯШмвКжаЃЌж№ЕЮЕЮМгЯЁNaOHШмвКЃЌMg2+зюЯШГСЕэ
D. дкpH=7ЕФШмвКжаЃЌFe3+ЁЂAl3+ЁЂFe2+ФмДѓСПЙВДц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФПЧАЙЄвЕЩЯгавЛжжЗНЗЈЪЧгУCO2ЩњВњШМСЯМзДМЃЈCH3OHЃЉЁЃвЛЖЈЬѕМўЯТЗЂЩњЗДгІЃКCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ЃЌЭМ1БэЪОИУЗДгІЙ§ГЬжаФмСП(ЕЅЮЛЮЊkJЁЄmolЁЊ1)ЕФБфЛЏЁЃ
CH3OH(g)+H2O(g)ЃЌЭМ1БэЪОИУЗДгІЙ§ГЬжаФмСП(ЕЅЮЛЮЊkJЁЄmolЁЊ1)ЕФБфЛЏЁЃ
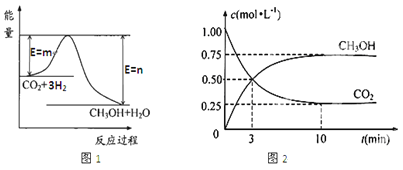
ЃЈ1ЃЉИУЗДгІЮЊ_________ШШЗДгІЃЌдвђЪЧ_____________________ЁЃ
ЃЈ2ЃЉЯТСаФмЫЕУїИУЗДгІвбОДяЕНЦНКтзДЬЌЕФЪЧ_________(ЬюађКХ)
AЃЎv (H2)=3v(CO2) BЃЎШнЦїФкЦјЬхбЙЧПБЃГжВЛБф
CЃЎvФц(CO2)=vе§(CH3OH) DЃЎШнЦїФкЦјЬхУмЖШБЃГжВЛБф
EЃЎCH3OH жа1 mol HЁЊOМќЖЯСбЕФЭЌЪБ2 mol C=OМќЖЯСб
F. ЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПВЛБф
ЃЈ3ЃЉдкЬхЛ§ЮЊ1 LЕФУмБеШнЦїжаЃЌГфШы1 molCO2КЭ3 molH2ЃЌВтЕУCO2КЭCH3OH(g)ЕФХЈЖШЫцЪБМфБфЛЏШчЭМ2ЫљЪОЁЃДгЗДгІПЊЪМЕНЦНКтЃЌгУЧтЦјХЈЖШБфЛЏБэЪОЕФЦНОљЗДгІЫйТЪv (H2)=________ЁЃ ДяЦНКтЪБШнЦїФкЦНКтЪБгыЦ№ЪМЪБЕФбЙЧПБШ____________ЁЃ
ЃЈ4ЃЉМзДМЁЂбѕЦјдкЫсадЬѕМўЯТПЩЙЙГЩШМСЯЕчГиЃЌЦфИКМЋЕФЕчМЋЗДгІЮЊ________________ЃЌ
гыЧІаюЕчГиЯрБШЃЌЕБЯћКФЯрЭЌжЪСПЕФИКМЋЮяжЪЪБЃЌМзДМШМСЯЕчГиЕФРэТлЗХЕчСПЪЧЧІаюЕчГиЕФ___________БЖЃЈБЃСєаЁЪ§ЕуКѓ1ЮЛЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМгШыNaOHШмвККѓЃЌШмвКжаФФжжРызгЪ§ФПЛсМѕЩйЃЈЁЁЁЁЃЉ
A.CO32Љ
B.Cu2+
C.SO42Љ
D.Ba2+
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com