
| A. | 6.02×1023个碳原子的质量为1 g | |
| B. | 钠原子的摩尔质量为23 g | |
| C. | HCl的摩尔质量等于6.02×1023个HCl分子的质量 | |
| D. | Na2O2的摩尔质量为78 g/mol |
分析 A.6.02×1023个碳原子的质量为$\frac{6.02×10{\;}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$×12g/mol=12g;
B.摩尔质量的单位是g/mol;
C.摩尔质量和质量的单位不同;
D.摩尔质量以g/mol为单位时,数值上等于其相对分子质量.
解答 解:A.6.02×1023个碳原子的质量为12g,6.02×1023个碳原子的物质的量为1mol,故A错误;
B.钠原子的摩尔质量为23 g/mol,故B错误;
C.摩尔质量与质量意义不同,单位也不相同,质量以g为单位,摩尔质量以g/mol为单位,摩尔质量以g/mol为单位,1 mol物质的质量与该物质的摩尔质量只是在数值上相等,故C错误;
D.Na2O2的相对分子质量是78,摩尔质量为78 g/mol,故D正确;
故选D.
点评 本题考查了摩尔质量,难度不大,注意质量、摩尔质量、相对分子质量的单位不同,摩尔质量以g/mol为单位时,数值上等于其相对分子质量或相对原子质量.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:多选题
| A. | NaX的水溶液的碱性一定强于NaY水溶液的碱性 | |
| B. | HX一定是弱酸 | |
| C. | 反应结束时两者所用时间相同 | |
| D. | 浓度:C(HX)>C(HY) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
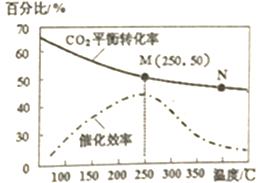 一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 平衡常数:KM<KN | |
| C. | 催化剂对CO2的平衡转化率没有影响 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
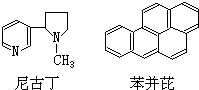 吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:
吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:| A. | 尼古丁的分子式为C10H14N2 | |
| B. | 尼古丁分子中的所有原子都在同一平面上 | |
| C. | 苯并芘的分子式为C20H18 | |
| D. | 苯并芘分子中含有苯环结构单元,是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32-和Br-浓度都会减小 | B. | 溶液颜色会发生变化 | ||
| C. | 该过程中不会有沉淀生成 | D. | 离子浓度基本保持不变的只有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100kg | B. | 160kg | C. | 240kg | D. | 300kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
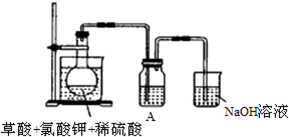
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硅酸钠与稀硫酸反应:Na2SiO3+2H+═2Na++H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com