
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 化学平衡发生移动时,化学反应速率一定变化 | |
| C. | 正反应进行的程度越大,正反应速率一定越大 | |
| D. | 使化学反应速率发生变化,而化学平衡不移动的影响因素,一定是催化剂 |
分析 化学平衡是否发生变化,取决于正逆反应速率的关系,如正逆反应速率相等,则平衡不移动,如正反应速率大于逆反应速率,平衡向正反应方向移动,否则向逆反应方向移动.
解答 解:A.正逆反应速率都变化但仍相等,则平衡不移动,故A错误;
B.化学平衡发生移动时,正逆反应速率不等,一定发生变化,故B正确;
C.正反应进行的程度越大,说明正反应速率大于逆反应速率,但正反应速率不一定增大,也可能减小,此时逆反应速率更小,故C错误;
D.如反应前后气体的体积不变,增大压强,平衡也不移动,故D错误.
故选B.
点评 本题考查化学平衡与反应速率的关系,题目难度不大,注意反应是否处于平衡状态,取决于正逆反应速率的大小关系.


科目:高中化学 来源: 题型:选择题
| A. | 绝热性 | B. | 绝缘性 | C. | 导热性 | D. | 熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物理量 | 样品质量/g | … | ||
| 实 验 | a | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
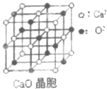 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y两元素形成的化合物可能存在共价键 | |
| B. | R的氢化物比Y的氢化物稳定 | |
| C. | Z、W、R最高价氯化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y与R以两种元素组成的常见化合物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com