
| A.1︰1 | B.1︰2 | C.1︰3 | D.2︰1 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.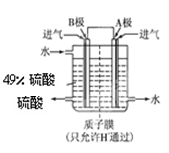
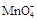 + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++ 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.75 | B.1.5 | C.2 | D.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
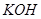 溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移
溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移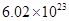 个电子,所得溶液中
个电子,所得溶液中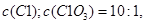 则参与反应的
则参与反应的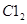 的物质的量为( )
的物质的量为( )A.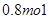 | B.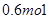 | C.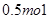 | D.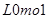 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性由强到弱的顺序为KBrO3 > KClO3 > Cl2 > Br2 |
| B.①中KCl是氧化产物,KBr 发生还原反应 |
| C.③中1mol氧化剂参加反应得到电子的物质的量为2mol |
| D.反应②中氧化剂与还原剂的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| V(Cl2)(标况,L) | 2.8 | 5.6 | 11.2 |
| n(Cl—) /mol | 1.5 | 1.75 | 2.25 |
| n(Br—) /mol | 1.5 | 1.4 | 0.9 |
| n(I—)/mol | a | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com