
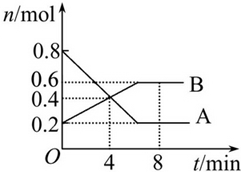
 8min时,v(正)=v(逆).
8min时,v(正)=v(逆). 分析 (1)根据图知,随着反应进行,A的物质的量减少、B的物质的量增大,所以A是反应物、B是生成物,反应达到平衡状态时,△n(A)=(0.8-0.2)mol=0.6mol,△n(B)=(0.6-0.2)mol=0.4mol,同一反应中同一时间段内各物质物质的量变化量之比等于其计量数之比,据此书写方程式;
(2)反应开始至4min时,A的平均反应速率=$\frac{\frac{△n}{V}}{△t}$;
(3)4min时,反应物生成物的物质的量相等,但反应仍然向正反应方向移动,所以v(正)>v(逆),8min时,该反应达到平衡状态,正逆反应速率相等.
解答 解:(1)根据图知,随着反应进行,A的物质的量减少、B的物质的量增大,所以A是反应物、B是生成物,反应达到平衡状态时,△n(A)=(0.8-0.2)mol=0.6mol,△n(B)=(0.6-0.2)mol=0.4mol,同一反应中同一时间段内各物质物质的量变化量之比等于其计量数之比,所以A、B的计量数之比=0.6mol:0.4mol=3:2,
所以该反应化学方程式为3A?2B,
故答案为:3A?2B;
(2)反应开始至4min时,A的平均反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.8-0.4)mol}{2L}}{4min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)4min时,反应物生成物的物质的量相等,但反应仍然向正反应方向移动,所以v(正)>v(逆),8min时,该反应达到平衡状态,正逆反应速率相等,所以v(正)=v(逆),
故答案为:>;=.
点评 本题考查物质的量随时间变化图象分析,明确曲线变化趋势、知道化学平衡状态的特征即可解答,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸与碱反应 | B. | 强酸与强碱反应 | ||
| C. | 一元强酸和一元碱反应 | D. | 强酸与强碱反应生成水和可溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  +HNO3$→_{△}^{浓盐酸}$ +HNO3$→_{△}^{浓盐酸}$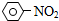 +H2O 取代反应 +H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br CH2Br; 加成反应 | |
| C. | CH3CH2OH+HCl→CH3CH2Cl+H2O; 酯化反应 | |
| D. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O; 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气,则乙一定是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据一次能源和二次能源的划分,氢气为二次能源 | |
| B. | 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 | |
| C. | 火电是将燃料中的化学能直接转化为电能的过程 | |
| D. | 原电池工作过程中是直接将化学能转化为电能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的己烷所含的分子数为0.5 NA | |
| B. | 28 g乙烯所含共用电子对数目为4 NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1n NA | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的邻位二溴代物只有一种能证明苯分子中不存在碳碳单、双键交替的结构 | |
| B. | 甲烷的一氯代物只有一种可证明甲烷为正四面体 | |
| C. | 1mol乙烯完全加成消耗1mol溴单质能证明乙烯分子里含有一个碳碳双键 | |
| D. | 1mol乙醇与足量的钠反应生成0.5mol氢气,可证明乙醇分子只有一个羟基 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
埋在地下的输油铸铁管道,在下列各种情况下,腐蚀速度最快的是( )
A.在潮湿的酸性土壤中 B.在潮湿不透气的中性土壤中
C.在干燥致密不透气的土壤中 D.在潮湿透气的盐碱地中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com