
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
B.放电时,Li+透过固体电解质向Cu极移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.请将括号中的杂质去除,依次写出除杂试剂和实验方法
例:CO2(HCl):饱和NaHCO3溶液,洗气。
①甲烷(乙烯):___________________,________。
②水(碘):___________________,________。
③HBr(Br2):___________________,________。
④溴苯(Br2):___________________,________。
⑤乙醇(乙酸):___________________,________。
⑥乙酸乙酯(乙酸):___________________,________。
Ⅱ.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关信息如下:
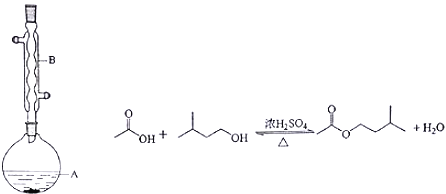
相对分子质量 | 沸点/℃ | 水中溶解度 | |
异戊醇 | 88 | 131 | 微溶 |
乙酸 | 60 | 118 | 溶 |
乙酸异戊酯 | 130 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是________________;
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层_________(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(3)本实验中加入过量乙酸的目的是_________________;
(4)实验中加入少量无水硫酸镁的目的是_________________;
(5)本实验的产率是____________。
A.30% B.40% C.50% D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求。一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3 +2Na2NiFeII (CN)6 ![]() Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是( )
Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是( )
A.放电时NaTi2(PO4)3在正极发生还原反应
B.放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中
C.充电过程中阳极反应式为:2NaNiFeIII(CN)6+2Na++2e-=2Na2NiFeII (CN)6
D.该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯结构简式如图所示。下列有关柠檬烯的分析正确的是( )

A. 它的一氯代物有6种
B. 它的分子中所有的碳原子一定在同一平面上
C. 它和丁基苯(![]() )互为同分异构体
)互为同分异构体
D. 一定条件下,它分别可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的有机产物,肯定是一种的是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2—氯丁烷(![]() )与NaOH溶液共热发生反应
)与NaOH溶液共热发生反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 等物质的量的甲烷和氯气的混和气体长时间光照后的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据及装置示意图如图表: ![]()
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |

实验步骤如下:
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸(密度为l.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V.粗产品经提纯后称重为5.7g
请回答下列问题:
(1)本实验所用50%的HNO3溶液物质的量浓度为 (保留一位小数),滴液漏斗中的细支管a作用是 。
(2)仪器b的名称为 ,其作用是 ,使用时要从 (填“上口”或“下口”)通入冷水。
(3)NaOH溶液的作用是 。溶液上方倒扣的漏斗的作用是 。
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是 。
(5)为了除去可能的杂质和减少产品损失,可分别用 和 洗涤晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某有机物的结构简式如图所示,关于该有机物的说法不正确的是

A.该有机物的化学式为C20H14O5
B.该有机物分子中的三个苯环不可能共平面
C.该有机物可发生加成、取代、氧化、消去等反应
D.1 mol该有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为500mol
II.绿原酸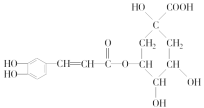 是一种抗氧化药物,存在如图所示的转化关系。
是一种抗氧化药物,存在如图所示的转化关系。

(1)绿原酸中的含氧官能团有酯基、________。
(2)B的分子式是__________________。
(3)C的氧化产物能发生银镜反应,则C→D的化学方程式是_______________。
(4)咖啡酸苯乙酯的结构简式是_______。
(5)1 mol A与足量的H2、浓溴水作用,最多可消耗H2________mol,浓溴水________mol。
(6)F是A的同分异构体,F分别与碳酸氢钠溶液或新制Cu(OH)2溶液反应产生气体或红色沉淀;苯环上只有两个取代基,且核磁共振氢谱表明该有机物中有8种不同化学环境的氢。
①符合上述条件的F有________种可能的结构;
②若F还能与NaOH在常温下以物质的量之比1∶2完全反应,其化学方程式为________ (任写1个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的下列物质:①甲醇②乙醇③乙二醇④丙三醇⑤乙烯,完全燃烧产生CO2的物质的量从大到小排序为:______________________________________(填序号)。
(2)下列有机物命名不正确的是:( )
A. 1,3,4-三甲苯
1,3,4-三甲苯
B. 2-甲基-2-氯丙烷
2-甲基-2-氯丙烷
C. 2-甲基-1-丙醇
2-甲基-1-丙醇
D. 3-甲基-1-丁炔
3-甲基-1-丁炔
(3)下列化合物在水中的溶解度,从大到小的排列次序为__________________(填序号)
①HOCH2CH2CH2OH ②CH3CH2CH2OH ③CH3CH2COOCH3 ④![]()
(4)下列体现有机物还原性的事实为( )
A.乙醛发生银镜反应
B.甲醛与新制的氢氧化铜悬浊液反应
C.丙酮与氢气发生加成
D.乙烯使酸性KMnO4溶液褪色
E.乙烯使溴水褪色
F.乙醇在铜的催化下与氧气作用生成乙醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com