
| A. | 离子半径:Q>W>Z>Y | |
| B. | 元素Y、Q的气态氢化物稳定性:Q>Y | |
| C. | 元素Z、W、Q的最高价氧化物对应水化物相互间能发生反应 | |
| D. | Y与X、Y与Z形成的化合物化学键类型相同. |
分析 X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,Y是所有元素中非金属性最强的元素.则Y为F元素;X是周期表中所有元素原子半径最小的,则X为H元素;X、Z同主族,Z为Na元素;Y、Q同主族,Q为Cl元素;W元素所处周期的序数等于其族序数,为第三周期ⅢA族的Al元素,以此来解答.
解答 解:X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,Y是所有元素中非金属性最强的元素.则Y为F元素;X是周期表中所有元素原子半径最小的,则X为H元素;X、Z同主族,Z为Na元素;Y、Q同主族,Q为Cl元素;W元素所处周期的序数等于其族序数,为第三周期ⅢA族的Al元素,
A.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径:Q>Y>Z>W,故A错误;
B.非金属性F>Cl,元素Y、Q的气态氢化物稳定性:Q<Y,故B错误;
C.元素Z、W、Q的最高价氧化物对应水化物NaOH、氢氧化铝、高氯酸相互间能发生反应,故C正确;
D.Y与X、Y与Z形成的化合物分别为HF、NaF,化学键类型分别为共价键、离子键,类型不同,故D错误;
故选C.
点评 本题考查位置、结构与性质,为高频考点,推断元素是解题的关键,注意基础知识的掌握,侧重分析与推断能力的考查,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 电池中的重金属等污染土壤,可以回收再利用以减少污染、保护资源 | |
| C. | 人们日常生活中用到各种化学品,应尽量减少甚至不使用 | |
| D. | 城市机动车成为PM2.5(直径≤2.5微米的颗粒物,也称为可入肺颗粒物,有毒、有害)主要源头,必须加以控制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向氯水中加入硝酸银溶液,有白色沉淀产生 | 氯水中已无Cl2 |
| B | 将SO2通入酸性高锰酸钾溶液,溶液紫色褪去 | SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入少量铁粉,没有红色固体析出 | 氧化性:Fe3+>Cu2+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
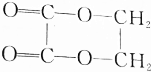 的化学方程式(无机试剂任选)并注明反应类型.
的化学方程式(无机试剂任选)并注明反应类型. (取代反应).
(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
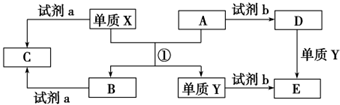
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )| A. | 4.32 g | B. | 2.16 g | C. | 1.08 g | D. | 0.54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
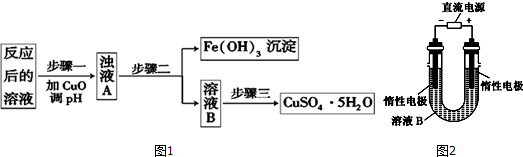
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com