
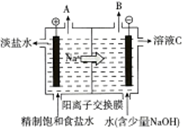
 电解饱和食盐水的原理如图所示.
电解饱和食盐水的原理如图所示.分析 (1)依据装置图左边接电源正极为阳极,氯离子失电子放出A为氯气,氯气能使湿润的淀粉碘化钾试纸变蓝;
(2)右边接负极为阴极,氢离子得电子放出氢气;
(3)电解饱和食盐水,依据电极反应判断生成产物,书写离子方程式;
(4)根据右边接负极为阴极,氢离子得电子放出氢气,剩余氢氧根与移动过来的钠离子结合成氢氧化钠溶液分析;
(5)根据阳极产物和平衡移动原理分析;
(6)根据得失电子守恒,NaCl转化为NaClO3所失去的电子等于H2O转化为H2所得到的电子,由氯酸钠的质量求出氯酸钠的物质的量,进而求出NaCl转化为NaClO3所失去的电子的物质的量,最后求出生成氢气在标准状况下的体积;
(7)根据反应物、产物写出相应的电解方程式,根据方程式进行计算.
解答 解:(1)由装置图左边接电源正极为阳极,氯离子失电子放出A为氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,则检验气体氯气所用试剂是湿润的淀粉碘化钾试纸,故答案为:湿润的淀粉碘化钾试纸;
(2)右边接负极为阴极,氢离子得电子放出氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(4)装置图右边接负极为阴极,氢离子得电子放出氢气,氢氧根离子浓度增大,剩余溶液C为氢氧化钠溶液,故答案为:NaOH;
(5)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O?HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
故答案为:Cl2与水的反应为Cl2+H2O?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;
(6)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,
设产生的H2体积为VL,
由得失电子守恒得:6×$\frac{213.0g}{116.5g•mol{\;}^{-1}}$=2×$\frac{V}{22.4}$; 解得V=134.4L.
故答案为:134.4;
(7)因电解饱和食盐水的方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,阳极产生224L(标准状况)气体时,即10molCl2时,生成氢氧化钠的物质的量为20mol,所以溶液中NaOH的物质的量浓度=$\frac{20}{2000}$═0.01mol/L,所以氢离子的浓度为$\frac{10{\;}^{-14}}{0.01}$=1×10-12mol/L,pH=12,故答案为:12.
点评 本题考查了电解池原理的分析应用,主要是电极反应,电极判断,电极反应式的书写,化学方程式的计算,难度不大,注意掌握化学方程式的计算是解题的关键.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用100mL量筒量取5.2mL稀硫酸 | |
| B. | 用碱式滴定管量取20.10mLCCl4 | |
| C. | 用托盘天平称取8.56g食盐 | |
| D. | 用酸式滴定管量取20.50mLKMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +3HNO3$\stackrel{浓硫酸}{→}$
+3HNO3$\stackrel{浓硫酸}{→}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为NaCl溶液导电,所以NaCl晶体中含有离子键 | |
| B. | 因为N的最外层电子数为5,所以N2中有3个非极性共价键 | |
| C. | 因为NH4Cl全部由非金属元素组成,所以NH4Cl是共价化合物 | |
| D. | 因为Na2O2中的原子个数比是1:1,所以离子个数比也是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液、振荡、静置分层后,除去水层 | |
| C. | 除去乙酸乙酯中少量的乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子中4个氢原子可能在同一平面上 | |
| B. | 乙烯分子中共6个原子都在同一平面上 | |
| C. | 苯分子中碳原子和全部氢原子不可能在同一平面上 | |
| D. | 乙炔分子中4个原子不可能在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 900 |
| 平衡常数 | 0.1 | X | 1 |
| A. | △H>0 | |
| B. | 平衡时,c(B)为0.6 mol•L-1 | |
| C. | 800℃时平衡常数X=4/9 | |
| D. | 900℃该反应达到平衡状态时,A的物质的量为0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CrO3+NH3+H2O | B. | Cr2O3+NH3+H2O | C. | CrO3+N2+H2O | D. | Cr2O3+N2+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com