
【题目】在一定温度下的可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
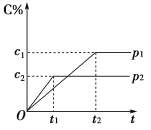
①p1>p2 ②p1<p2 ③m+n>p+q ④m+n=p+q ⑤m+n<p+q
A. ①③ B. ②③ C. ②⑤ D. ①④
科目:高中化学 来源: 题型:
【题目】下列关于下图所示电化学装置的分析正确的是

A. 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜
B. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
D. 若X为导线,Y为铜棒,则Fe棒发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计如图装置。请回答下列问题:
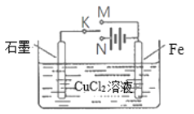
(1)若K与M、N均断开,发生的离子反应为____________________。
(2)若K与M相连、与N断开,石墨为_________(填电极名称)。
(3)若K与N相连、与M断开,石墨电极处的现象为____________________。
(4)若将CuCl2溶液换成精制饱和食盐水,仍保持K与N相连、与M断开,此时装置中发生的离子反应方程式为_______________________________。若此反应过程中转移1mol电子,理论上共产生标准状况下气体__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:
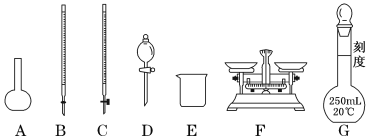
(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。

下列说法错误的是
A. 甲同学认为步骤1中使用1,2-二氯乙烷的目的是做催化剂,加快反应速率
B. 乙同学认为可在该实验装置的冷凝管后加接一只装有无水MgSO4的干燥管,实验效果可能会更好
C. 丙同学认为步骤2中有机相使用10%NaHCO3溶液洗涤可除去大部分未反应完的Br2
D. 丁同学认为步骤4中减压蒸馏有机相是因为间溴苯甲醛高温下容易氧化或分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
(2)25 ℃时,0.1 mol·L-1的HA溶液中![]() =1010。请回答下列问题:
=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是__________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法正确的是( )
A. 钠是银白色金属、密度比水略大 B. 钠着火时,可用水灭火
C. 金属钠在空气中燃烧,生成氧化钠 D. 通常情况下,钠的熔点略低于水的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com