
| m |
| M |
| 12.4g |
| 62g/mol |
| 10.8g |
| 18g/mol |
| 17.6g |
| 44g/mol |
| 0.4mol |
| 0.2mol |
| 1.2mol |
| 0.2mol |
| 62-12×2-6 |
| 16 |
| 4.48L |
| 2.24L/mol |
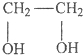 ,
,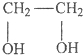 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4) | ||
B、
| ||
| C、c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(H2C2O4) | ||
| D、加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | K2CO3 | KHCO3 | K2SO3 |
| 质量(kg) | 55.2 | 120.0 | 63.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液滴加过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++H2O |
| B、硫酸和氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
| C、向氯化钙溶液中通入CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ |
| D、向氢氧化铁胶体中滴加足量HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com