
【题目】下列说法正确的是
A. 某温度时,1LpH = 6的水溶液,含1.0×10-6molOH-离子
B. 含10.6g Na2CO3溶液中,所含阴离子总数等于0.1mol
C. 用TiCl4制备TiO2:TiCl4 +(x+2) H2O(过量)= TiO2·xH2O↓+ 4HCl
D. 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂
【答案】C
【解析】
A、某温度时,如果溶液为中性水溶液,pH=6的水溶液中含有c(OH-)=1×10-6mol·L-1,如果溶液为酸性,则有c(OH-)=Kw/c(H+),不知道温度,Kw无法判断,即无法计算出c(OH-),故A错误;
B、10.6gNa2CO3的物质的量为0.1mol,Na2CO3溶于水,CO32-发生水解:CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-,所含阴离子总数大于0.1mol,故B错误;
H2CO3+OH-,所含阴离子总数大于0.1mol,故B错误;
C、利用Ti4+水解程度很大,可以制备TiO2·xH2O,得出TiCl4 +(x+2) H2O(过量)= TiO2·xH2O↓+ 4HCl,故C正确;
D、恰好反应后,溶液显碱性,应用酚酞作指示剂,故D错误。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列装置为某实验小组设计的 Cu-Zn 原电池,关于其说法错误的是

A. 装置甲中电子流动方向为:Zn→电流表→Cu
B. 装置乙比装置甲提供的电流更稳定
C. 装置乙盐桥中可用装有琼胶的 Na2CO3饱和溶液
D. 若装置乙中盐桥用铁丝替代,反应原理发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为了验证SO2和Cl2的漂白性,设计了如下图所示的实验装置。请回答下列问题:
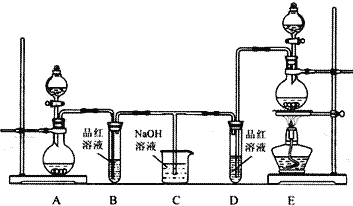
(1)他们制备SO2和Cl2所依据的原理分别是:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑、MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是______(填序号),反应中盐酸所表现的性质是______性和______性,生成71gCl2转移的电子是______mol;
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是______(填序号),反应中盐酸所表现的性质是______性和______性,生成71gCl2转移的电子是______mol;
(2)反应开始后,发现B、D试管中的现象均为____________________________,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是________________________________;
(3)装置C的作用是____________________________________________________________;
(4)NaOH(足量)溶液与Cl2反应的离子方程式是__________________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C2H4及C2H2等均可用适当的羧酸盐采用Kolbe电解法得到。如图为制取C2H2的电解装置,该装置工作时,下列说法中错误的是

A. 电能转变为化学能
B. 阴极周围溶液的pH不断升高
C. 电极a上发生:![]()
D. 制取乙烯可用CH3COOK溶液作阳极电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。
(1)已知:C(s)+O2(g)![]() CO2(g) △H=-393.5kJ/mol
CO2(g) △H=-393.5kJ/mol
N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
则C(s)+2NO(g)![]() CO2(g)+N2(g)的△H=___________ kJ/mol
CO2(g)+N2(g)的△H=___________ kJ/mol
(2)用焦炭还原NO2的反应为2 C(s)+2NO2(g)![]() N2(g)+2CO2(g),向两个容积均为2L、反应温度分别为T1℃、T2℃的恒温恒容密闭容器中分别加入足量的焦炭和一定量的NO2,测得各容器中n(NO2)随反应时间t的变化情况如图所示;
N2(g)+2CO2(g),向两个容积均为2L、反应温度分别为T1℃、T2℃的恒温恒容密闭容器中分别加入足量的焦炭和一定量的NO2,测得各容器中n(NO2)随反应时间t的变化情况如图所示;
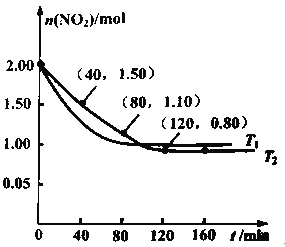
①T1___________T2(填“>”或“<”),该反应为___________(填“放热”或“吸热”)反应。
②T2℃时,40~80min,用N2的浓度变化表示的平均反应速率为v(N2)=___________,此温度下的化学平衡常数K=___________。
③T2℃下,120min时,向容器中再加入焦炭和NO2各1mol,在t时刻达到平衡时,NO2的转化率比原平衡时___________(填“增大”、“减小”或“不变”)。
(3)工业上消除氮氧化物的常用方法是SCR(选择性催化还原)脱硝法,反应原理为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
①SCR法除NO,投料比一定时有利于提高NO平衡转化率的反应条件是___________、___________。
当反应温度过高时,会发生以下副反应:2NH3(g)+2O2(g)![]() N2O(g)+3H2O(g);4NH3(g)+5O2(g)
N2O(g)+3H2O(g);4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
②某科研小组通过系列实验,分析得出脱硝率与氨氮比[ NH3/NOx表示氨氮比]、温度的关系如图所示,从图一可以看出,最佳氨氮比为2.0,理由是______________________;由图二可知,当温度高于405℃后,脱硝率会逐渐减小,原因是______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,向A中充入一定量H2、O2的混合气体,向B中充入1mol空气,此时活塞的位置如图所示。

(1)A室混合气体的物质的量为_______。
(2)实验测得A室混合气体的质量为34g,A室中含氧气_______mol;该混合气体的密度是同温同压时H2密度的 _______倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留在_____刻度处,容器内气体压强与反应前气体压强之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算:
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为____mol·L-1。
(2)若从中取出50mL,其物质的量浓度为____mol·L-1;溶质的质量为___g。
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为____mol·L-1,SO42-的物质的量浓度为_____mol·L-1。
(4)已知:a g某气体A含有b个分子,则c g该气体在标准状况下的体积为____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+
C. 氢氧化镁溶于盐酸:Mg(OH)2+H+=Mg2++H2O
D. Cu(OH)2与稀硫酸反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com