
下列元素的电子排布式各违背了哪一规律
(1)21Sc 1s22s22p63s23p63d3
(2)22Ti 1s22s22p63s23p10
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)2.24 L CO2中含有的原子数为0.3NA( )
(2)常温下11.2 L甲烷气体含有的甲烷分子数为0.5NA( )
(3)标准状况下,22.4 L己烷中含共价键数目为19NA( )
(4)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA( )
(2012·新课标全国卷,9D)
(5)标准状况下,2.24 L HF含有的HF分子数为0.1NA( )
查看答案和解析>>
科目:高中化学 来源: 题型:
实验中需要2 mol·L-1的Na2CO3溶液950 mL,配制时,你认为应该选用的容量瓶的规格和称取的碳酸钠质量分别是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向50 g浓度为c mol·L-1、密度为ρ g·cm-3的氨水中加入一定量的水,将其稀释至0.5c mol·L-1,则加入水的体积( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
用霞石岩(主要成分为Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。

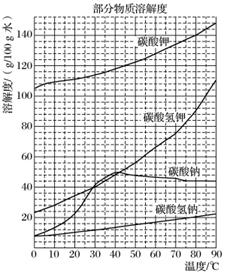
溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度如上图,根据题意回答下列问题:
(1)固体M的化学式是________,X物质是________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是________,滤液W中主要含有的离子有________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是________________________________________________________________________。
(4)操作Ⅰ是________(填写名称),操作Ⅱ是________(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是________________________________________________________________________,
产品K2CO3中最可能含有的杂质是__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列几组化合物的熔、沸点由高到低的顺序,并简要说明判断理由。
(1)CCl4、CF4、CBr4、CI4:_______________________________________________
________________________________________________________________________
__________________________________。
(2)乙醇、溴乙烷、乙烷:________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图表示某固态
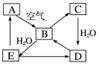
单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式:
________________________________________________________________________。
(2)写出E与A的氢化物反应生成A的化学方程式:
________________________________________________________________________。
(3)写出一个由D生成B的化学方程式:
________________________________________________________________________。
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式:_______________________________________________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________________________________________________________________________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com