
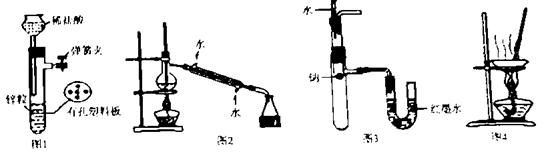
ij��ѧѧϰС�������ͼʵ��װ�ã��г�װ����ȥ���Ʊ�Cl2����̽��������������ʣ�
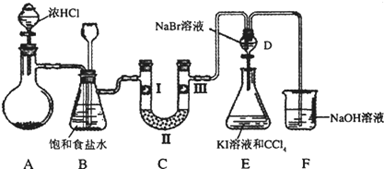
��1����Aװ���й���ҩƷΪMnO2,�仯ѧ����ʽΪ
��Aװ���й���ҩƷΪKClO3����Ӧ��ÿ����1molCl2ʱת�Ƶ��ӵ����ʵ���Ϊ mol��
��2��װ��B�����ã�
��3��װ��C����������֤�����Ƿ����Ư���ԣ�l����ʪ�����ɫ���������Ӧ��������ʷֱ��� ��
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢��ķǽ����ԡ�����ͬѧ��Ϊ����Ʋ������ܣ��������ɿ��� ��
��5�����û�ѧ����ʽ˵��װ��F������ ��
��6����ͬѧ�����װ��F�е��Լ��ɸ��ù�����Na2SO3��Һ����ͬѧ����˼������Ϊ�˷������У��������ӷ���ʽ��������Ϊ�����е�ԭ��
��֪ʶ�㡿��������ȡ������ D2 J1 J3
���𰸽�������1�� MnO2+4HCl(Ũ��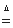 MnCl2 + Cl2��+2H2O (2 �֣� 5/3��2�֣�
MnCl2 + Cl2��+2H2O (2 �֣� 5/3��2�֣�
��2�����ܳ�ȥ�����е��Ȼ��⣬���ܼ��ʵ�������װ��C�Ƿ���������2�֣������1�֣�
��3����ˮ�Ȼ��ƣ��轺��P2O5�����������ɫ����������1�֣���2�֣�
��4����D�����й�������������֤�������ķǽ�����ǿ����2�֣�
��5��Cl2+2NaOH=NaCl+NaClO+H2O����2�֣�
��6��SO32-+Cl2+H2O=SO42-+2Cl-+2H+��SO32-+2H+=SO2��+2H2O ��2�֣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ȼҵ�IJ���NaOH�벻ͬ���ʷ�Ӧ�������ɲ�ͬ���Ρ���֪�����£�Ũ�Ⱦ�Ϊ0.1 mol/L��
4��������ҺpH���±���
| ���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
����˵���У� ��ȷ����( )
A������ˮ�м���NaHCO3������������ˮ�д������Ũ��
B��������Һ�У�ˮ�ĵ���̶�������NaClO
C�������£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH������H2SO3
D��NaHSO3��Һ������Ũ�ȴ�С˳��Ϊc��Na+��> c��H+��>c��HSO3-�� >c��SO32-��>c��OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͭ�Ƚ������仯�������ճ�������������;�dz��㷺��
��.��ȸʯ��Ҫ��Cu2(OH)2CO3,��������Fe��Si�Ļ����ʵ�����Կ�ȸʯΪԭ���Ʊ�CuSO4��5H2O��CaCO3���������£�
��ش��������⣺
��1����ҺA�Ľ���������Cu2+��Fe2+��Fe3+�������������Լ���ѡ��ʵ�鲽�����Լ���Ϊ��������������ţ���������ҺA��Fe3+������Լ�Ϊ��������������ţ���
a��KMnO4����������b�� (NH4) 2S������ c�� H2O2�������� d��KSCN
��2������ҺC���CuSO4��5H2O����Ҫ������������ �Ȳ�����
��3���Ʊ�CaCO3ʱ��Ӧ��CaCl2��Һ��ѡͨ�루���ȼ��룩�����������ѧʽ������ʵ��������а����ݳ���Ӧѡ��������������װ�û��գ�����ţ���
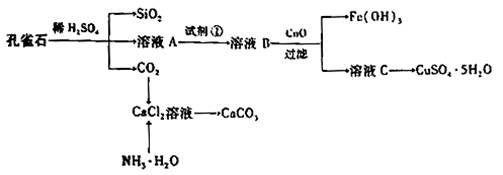
��.��1��ijͬѧ���Ӻ�FeCl3��FeCl2��CuCl2�ķ�Һ�л��ս���ͭ��ȡ����1L��Һ�������ۣ���ַ�Ӧ���������۵����ʵ������Һ��ͭ���ӵ����ʵ����Ĺ�ϵ������ͼ��
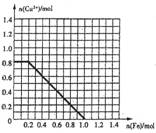 ��֪ԭ��Һ��c(Cl-)=6.0mol��L-1����ԭ��Һ��c(Fe3+)= ��c(Fe2+)= ��������ˮ�⼰��Һ����仯��
��֪ԭ��Һ��c(Cl-)=6.0mol��L-1����ԭ��Һ��c(Fe3+)= ��c(Fe2+)= ��������ˮ�⼰��Һ����仯��
��2������Fe2O3��ZnO��CuO�Ļ�Ϲ����ĩag���ڼ�����������������CO��ԭ���õ����������2.41g�������ɵ�CO2�����������ij���ʯ��ˮ���պ���5.00g��ɫ��������ش��������⣺
��a= ��
����agFe2O3��ZnO��CuO�Ļ���������ʵ���Ϊbmol����Fe2O3�����ʵ���Ϊ �����ú�b�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������������Ӻ���(xNa2SO4��yH2O2��zH2O)����ɿ�ͨ������ʵ��ⶨ��
��ȷ��ȡ1.77g��Ʒ�����Ƴ�100.00 mL��ҺA��
��ȷ��ȡ25.00 mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����0.582 5 g��
��ȷ��ȡ25.00 mL��ҺA��������ϡ�����ữ����0.02 mol��L��1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һ25.00 mL���ش��������⣺
(1)�ٲ��淶��ʵ������ᵼ��ʵ���������������в�����ʵ������Ӱ��ƫС���ǣ�������ţ� ��
A�����ܽ������������Һ�彦���ձ���
B������ʱ���������ϵĿ̶���
C�����ݺ�����ƿ��ҡ�Ⱥ��÷���Һ����ڿ̶��ߣ������ּ�������ˮ���̶���
(2) ������õ�KMnO4��Һ���� ������ʽ����ʽ�����ζ��ܣ��жϵζ��յ��ʵ��������
��3��ͨ������ȷ����Ʒ����� (д���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
.����˵����ȷ���ǣ� ��
A����25ml��Ͳ��ȡ12.3ml�����������ƽ��ȡ8.75gʳ��
B����pH��ֽ���ij��ˮ��pHΪ2���ñ�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��ȥNaOH��Һ23.10ml
C������������Ϊ5%��25%�İ�ˮ�������Ϻ�������Һ�����ʵ�������������15%
D��Ũ������뱣������ɫ����ƿ�У��Ʊ��뱣����ú����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�������ʽṹ�����ʡ�
���������з�Ӧ�ϳ������谷��CaO��3C CaC2��CO����CaC2��N2
CaC2��CO����CaC2��N2  CN2��C��CaCN2��2H2O===NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
CN2��C��CaCN2��2H2O===NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
��1��д����Ca��ͬһ������������������ͬ���ڲ��������ӵĻ�̬ԭ�ӵĵ����Ų�ʽ�� �� CaCN2��������ΪCN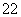 �����ݵȵ���ԭ��������֪CN
�����ݵȵ���ԭ��������֪CN �Ŀռ乹��Ϊ ��
�Ŀռ乹��Ϊ ��
 ��2�����ط�����Cԭ�Ӳ�ȡ �ӻ������ط��ӵĽṹ��ʽ�� ��
��2�����ط�����Cԭ�Ӳ�ȡ �ӻ������ط��ӵĽṹ��ʽ�� ��
��3�������谷( )�׳ơ����������������������谷����������( )
�����������������谷�����֮��ͨ�� ��ϣ������������γɽ�ʯ��
��4��CaO������ͼ��ʾ��CaO������Ca2+����λ��Ϊ ��
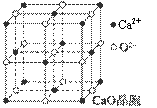

��5��CaO�����NaCl����ľ����ֱܷ�Ϊ��CaO 3401 kJ��mol-1��NaCl 786 kJ��mol-1������CaO��NaCl�����ܴ����Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
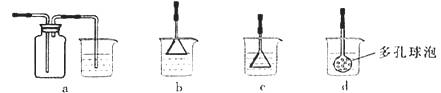
������װ�ý���ʵ�飬�����ȷ���ܴﵽʵ��Ŀ�ĵ���
A.��ͼ1��ʾװ����ȡ����H2
B.��ͼ2��ʾװ�÷���Na2CO3��Һ��CH3COO C2H5�Ļ����
C.��ͼ3��ʾװ����֤Na��ˮ��ӦΪ���ȷ�Ӧ
D.��ͼ4��ʾװ������NH4Cl������Һ�Ʊ�NH4Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������Ȼ�ѧ����ʽ��
H2(g)�� O2(g)===H2O(g)����H��a kJ·mol��1
O2(g)===H2O(g)����H��a kJ·mol��1
H2(g)��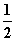 O2(g)===H2O(l)����H��b kJ·mol��1
O2(g)===H2O(l)����H��b kJ·mol��1
2H2(g)��O2(g)===2H2O(l)����H��c kJ·mol��1
���й������ǵı�����ȷ����(����)������������������������������������
A�����Ƕ������ȷ�Ӧ������ B��a��b��c��Ϊ��ֵ
C��a��b D��2b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�ֻ�������ȼ�ϵ��ԭ����Ƶľƾ�����ǣ������ϵķ�ӦΪCH3CH2OH-4e-+H2O====CH3COOH+4H+�������й�˵����ȷ����( )
A.���ʱ���������Һ�е�H+���ƶ�
B.����0.4 mol����ת�ƣ����ڱ�״��������4.48 L����
C.��ط�Ӧ�Ļ�ѧ����ʽΪ��CH3CH2OH+O2====CH3COOH+H2O
D�������Ϸ����ķ�Ӧ�ǣ�O2+4e-+2H2O====4OH-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com