
化学与生产生活、环境保护密切相关。下列说法中不正确的是
A.食盐既可作调味品也可作食品防腐剂
B.向海水中加入净水剂明矾可以使海水淡化
C.加大石油、煤炭的开采速度,增加化石燃料的供应不利于“蓝天工程”的建设
D.高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:2014-2015湖北省高一3月月考化学试卷(解析版) 题型:选择题
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
(双选)短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中Y所处的周期序数与族序数相等。W最外层电子数是内层电子数的3倍。下列说法正确的是
… | W | |||
X | Y | … | Z |
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的稳定性小于Z的气态氢化物的稳定性
D.W与Y形成的化合物可分别与NaOH溶液和盐酸反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
已知平衡:①C2H4(g)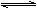 C2H2(g)+H2(g),②2CH4(g)
C2H2(g)+H2(g),②2CH4(g)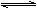 C2H4(g)+2H2(g)。当升高温度时,①和②式皆向右移动。
C2H4(g)+2H2(g)。当升高温度时,①和②式皆向右移动。
(1)C(s)+2H2(g)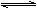 CH4(g)
CH4(g) 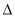 H1
H1
(2)2C(s)+H2(g)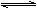 C2H2(g)
C2H2(g) 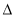 H2
H2
(3)2C(s)+2H2(g)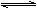 C2H4(g)
C2H4(g) 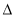 H3
H3
下列有关(1)、(2)和(3)中的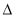 H1、
H1、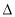 H2、
H2、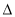 H3大小顺序排列正确的是
H3大小顺序排列正确的是
A.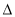 H1>
H1>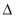 H2>
H2> H3 B.
H3 B.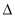 H2>
H2>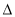 H3>2
H3>2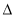 H1
H1
C.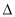 H2>
H2>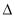 H1>
H1>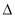 H3 D.
H3 D.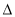 H3>
H3> H2>2
H2>2 H1
H1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
下列关于有机物的描述正确的是
A.葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体
B.淀粉、油脂和蛋白质都能发生水解反应
C.多糖、蛋白质、脂肪和聚丙烯都属于高分子化合物
D.汽油、柴油和植物油都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:实验题
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
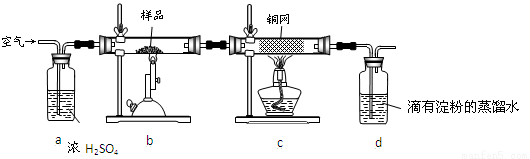
现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
(1)将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是_ ___和__ __(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。
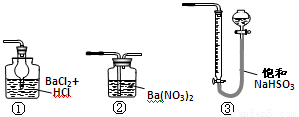
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:选择题
下列对图象描述正确的是

A.图①表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系
B.图②表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应过程中,SO2和O2反应速率大小关系
2SO3(g)反应过程中,SO2和O2反应速率大小关系
D.图④表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:填空题
(14分)SO2 、CO 、NOx 是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g) + O2(g)  2SO3(g) △H1 = - 197 kJmol-1
2SO3(g) △H1 = - 197 kJmol-1
H2O(g) = H2O(l) △H2 = - 44 kJmol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3 = - 545 kJmol-1
则SO3(g)与H2O(l)反应的热化学方程式是 。
(2)若反应2H2(g)+ O2 (g)=2H2O(g ),△H=-241.8kJmol-1,根据下表数据则x=______kJmol-1。
化学键 | H-H | O═O | O-H |
断开1mol化学键所需的能量/kJ | 436 | x | 463 |
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H=-90 kJmol-1
CH3OH(g) △H=-90 kJmol-1
①该温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO (g)和2 mol H2(g) | 1 mol CH3OH(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出54kJ | 吸收a kJ |
则c1_________ c2(填“>”或“<”或“=”),a=____________。
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。若Ⅱ反应的n(CO)起始 =10 mol、投料比为0.5,则:
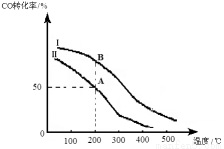
A点的平衡常数KA= ,
B点的平衡常数KB KA。 (填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是 (至少答出两条)。
(4)电解NO制备NH4NO3,其工作原理如图所示,
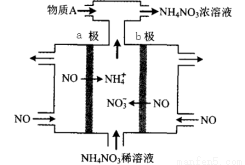
则a电极名称为_______,
b电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省台州市高三3月调研考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.合成氨反应在低温下能够自发进行,是因为反应物键能之和大于生成物键能之和
B.元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属元素
C.人们利用元素周期律在过渡元素中寻找各种性能优良的催化剂,以降低化学反应的活化能,从而起到很好的节能效果
D.超高分辨率荧光显微镜能够观察到纳米尺度的物质,用它可以获得蛋白质溶液中的分子图像
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com