
【题目】下列说法在一定 条件下可以实现的有
①酸性氧化物与碱反应生成酸式盐 ②没有水生成,也没有沉淀和气体生成的复分解反应
③有单质参加的非氧化还原反应 ④两种氧化物反应的产物有气体
A. 1 个 B. 2 个 C. 3 个 D. 4个
科目:高中化学 来源: 题型:
【题目】某混合溶液中溶质所含离子的物质的量浓度如表,则下列有关说法不正确的是( )
溶质所含离子 | SO42﹣ | M | Mg2+ | Fe2+ |
物质的量浓度 | c | 3 | 3 | 2 |
A.若M是NO3﹣ , 则c为3.5
B.若使Fe2+浓度降低,可以加入试剂NaOH
C.若M是NH4+ , 则配制溶液所用的溶质不一定是3种
D.若加入BaCl2溶液能产生两种沉淀,则M可能是CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl对反应具有促进作用,而![]() 对反应没有影响;
对反应没有影响;
原因Ⅱ:________________________________________;
原因Ⅲ:Cl对反应具有促进作用,而![]() 对反应具有阻碍作用;
对反应具有阻碍作用;
原因Ⅳ:Cl、![]() 均对反应具有促进作用,但Cl影响更大;
均对反应具有促进作用,但Cl影响更大;
原因Ⅴ:_____________________________。
(2)该同学设计并进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
①在盛有硫酸的试管中加入少量NaCl或KCl 固体,观察反应速率是否发生变化;
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否发生变化。若观察到实验1中__________,实验2中__________,则说明原因Ⅲ是正确的。以此类推,该同学通过分析实验现象,得出了结论:Cl对反应具有促进作用。
(3)为了使实验”定量化”,使结果更精确,可以对实验进行如下改进:
①配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1 mol L1的盐酸和密度为1.225 g cm3、质量分数为20%的硫酸,若要准确量取该硫酸20.00 mL,需要用酸式滴定管(一种能够精确测量溶液体积的仪器)将量取的硫酸配制成c(H+)=l molL1的溶液,可得溶液的体积为________________________________。配制溶液时还需要用到的玻璃仪器有______________、烧杯、胶头滴管和量筒等。
②比较反应速率:反应时间可以用停表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)结构简式为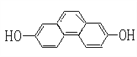 的有机物,在原子核磁共振氢谱(PMR)上观察峰给出的强度之比______。
的有机物,在原子核磁共振氢谱(PMR)上观察峰给出的强度之比______。
(2)实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。如分子式为C3H6O2的链状有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:① 3∶3 ②3∶2∶1 ③3∶1∶1:1 ④2:2:1:1 ,请分别推断出①和④对应的结构简式:①______,④_______________。
(3)在有机物:①CH3CH3 ②CH2=CH2 ③CH3CH2C≡CH ④CH3C≡CCH3⑤C2H6 ⑥CH3CH=CH2中,一定互为同系物的是____,一定互为同分异构的是______。(填编号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH + H2![]() LiNH2+LiH。下列有关说法正确的是( )
LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等 D. 此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )

A. 逸出气体的体积:a电极的小于b电极的
B. a电极附近呈蓝色,b电极附近呈红色
C. a电极附近呈红色,b电极附近呈蓝色
D. 一电极逸出无味气体,另一电极逸出刺激性气味气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,溶液体积均为200 ml ,开始时,电解质溶液的浓度均为0.1 mol·L-1 ,工作一段时间后,测得导线上通过了0.02 mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )

A. (1)、(2)两装置均为电解池
B. (1)、(2)溶液的PH均减小
C. (1)中阳极电极反应式为:4OH--4e-===2H2O+O2↑
D. (1)中阴极上析出0.32 g Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室迅速制备少量氯气可利用如下反应:KMnO4+HCl→KCl+MnCl2+Cl2+H2O(未配平)此反应不需要加热,常温下就可以迅速进行,而对盐酸浓度要求不高.结合本题,回答下列问题.
(1)上述反应中被氧化的物质是 , 还原产物是 .
(2)当反应有22.4LCl2(标准状况下)生成时,转移的电子的物质的量为 .
(3)Fe2+也能使KMnO4反应生成MnCl2 , 可推测Fe2+具有 . (填“氧化性”或“还原性”)
(4)如果该反应方程式中KMnO4和MnCl2的系数都是2,则HCl的系数是 .
(5)另知反应Cl2+2I﹣=I2+2Cl﹣ , 请按照氧化性由强到弱的顺序排列I2、Cl2、KMnO4三种物质: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com