
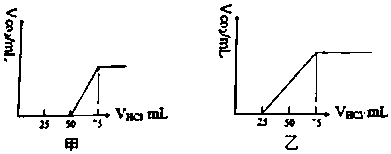
分析 当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑.
(1)甲中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(2)乙中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3;中和Na2CO3消耗HCl的体积为25mL,根据反应消耗盐酸的体积计算NaHCO3、Na2CO3的物质的量之比;
(3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl),进而计算原氢氧化钠溶液的浓度.
解答 解:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑.
(1)甲中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1;
故答案为:NaOH、Na2CO3,1:1;
(2)乙中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3;中和Na2CO3消耗HCl的体积为25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaHCO3、Na2CO3的物质的量之比=25mL:25mL=1:1;
故答案为:NaHCO3、Na2CO3;1:1;
(3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=$\frac{0.0075mol}{0.01L}$=0.75mol/L,
故答案为:0.75mol/L.
点评 本题考查混合物的计算,根据消耗盐酸的体积分析图象中各阶段发生的反应,进而判断氢氧化钠与二氧化碳反应的溶质是关键,题目难度较大,侧重于考查学生的分析能力和计算能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 选用的试剂 | 操作方法 |
| ① | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| ② | CO2(CO) | 氧气 | 点燃 |
| ③ | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| ④ | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)→SO2(g) Q1 kJ; S(g)+O2(g)→SO2(g) Q2 kJ | |
| B. | 2H2(g)+O2(g)→2H2O(g) Q1kJ; 2H2(g)+O2(g)→2H2O(l) Q2kJ | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l) Q1kJ; NaOH(aq)+CH3COOH(aq)→CH3COONa(aq)+H2O(l) Q2 kJ | |
| D. | H2(g)+Cl2(g)→2HCl(g) Q1kJ; H2(g)+F2(g)→2HF(g) Q2kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
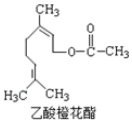
| A. | 分子式为 C12H22O2 | |
| B. | 1mol 该有机物水解时只能消耗 1 mol NaOH | |
| C. | 能使酸性 KMnO4溶液褪色,能发生加成反应,但不能发生取代反应 | |
| D. | 1mol 该有机物在一定条件下和 H2反应,共消耗 H2 为 3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com