
����Ŀ����������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
����ƽ�ⳣ�� ��25���� | Ka=1.77��104 | Ka=4.9��1010 | Ka1=4.3��107 Ka2=5.6��1011 |
����ѡ����ȷ����
A��NaCN��Һ��ͨ������CO2������c(Na+) > c(![]() ) >c(
) >c(![]() )
)
B��ϡ�͵��������Ũ�ȵ�HCOOH��HCN����ͬpH����ˮ�����ǰ��С�ں���
C�����ʵ���Ũ����ȵ�HCOONa��KCN��Һ����c(Na+)c(HCOO) >c(K+)c(CN)
D�����������Ũ�ȵ�HCOOH��NaCN�����Һ����c(H+)+c(HCN) =c(HCOO)+c(OH)
���𰸡�AD
��������
���������A��������ĵ���ƽ�ⳣ��С��̼�������̼�����������������������������̼���ǿ��̼���������������ǿ����ȡ����֪̼����軯����η�Ӧ�����������̼��������![]() �������
�������![]() ����ȷ��B����ΪHCOOH�ĵ���ƽ�ⳣ������HCN�ĵ���ƽ�ⳣ����Ũ����ͬ��HCOOH��pH���ͣ�ϡ�͵���ͬ��pH��Ҫˮ�������࣬������C�����������غ�ɵ�����Һ�ֱ������c(Na+)c(HCOO)=c(HCOOH)��c(K+)c(CN)=c(HCN)������Խ��Խˮ��Ĺ��ɣ�c(HCOOH)<c(HCN)����c(Na+)c(HCOO)<c(K+)c(CN)������D�����ڵĵ���غ�Ϊc(Na+)+c(H+)=c(CN) +c(HCOO)+c(OH)�������غ�Ϊc(Na+)=c(CN) +c(HCN )������õ�c(H+)+c(HCN) =c(HCOO)+c(OH)����ȷ��
����ȷ��B����ΪHCOOH�ĵ���ƽ�ⳣ������HCN�ĵ���ƽ�ⳣ����Ũ����ͬ��HCOOH��pH���ͣ�ϡ�͵���ͬ��pH��Ҫˮ�������࣬������C�����������غ�ɵ�����Һ�ֱ������c(Na+)c(HCOO)=c(HCOOH)��c(K+)c(CN)=c(HCN)������Խ��Խˮ��Ĺ��ɣ�c(HCOOH)<c(HCN)����c(Na+)c(HCOO)<c(K+)c(CN)������D�����ڵĵ���غ�Ϊc(Na+)+c(H+)=c(CN) +c(HCOO)+c(OH)�������غ�Ϊc(Na+)=c(CN) +c(HCN )������õ�c(H+)+c(HCN) =c(HCOO)+c(OH)����ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǿ����ʵĻ����Һ10 L�����п��ܺ�K+��Ba2+��Na+��![]() ��Cl��
��Cl��![]() ��
��![]() ��OH�еļ��֣�������ͨ��CO2���壬��������������ͨ��CO2����֮��Ĺ�ϵ����ͼ��ʾ��
��OH�еļ��֣�������ͨ��CO2���壬��������������ͨ��CO2����֮��Ĺ�ϵ����ͼ��ʾ��
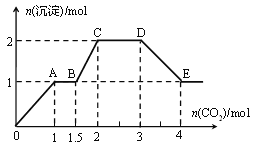
����˵����ȷ����
A������Һ����ȷ�����ڵ�������Ba2+��![]() ��
��![]()
B���϶������ڵ�������![]() ��OH
��OH
C��������ȷ�������������ٻ�����һ�������ӣ�������ӵ���СŨ��Ϊ0.2 mol��L1
D��OA �η�Ӧ�����ӷ���ʽ��2![]() +CO2+3H2O===2Al(OH)3��+
+CO2+3H2O===2Al(OH)3��+![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������п������þ���ֽ����е�������ɵĻ����11 g�������������ᷴӦ�����������ڱ�״����Ϊ11.2 L����������һ�����еĽ�����(����)
A. �� B. п C. þ D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���������������ȣ��� �� ��
A. ����ԭ����һ�����B. ���ʵ���һ����ͬC. ����һ����ͬD. �ܶ�һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00mL 0.1000mol��L-1(NH4)2SO4��Һ����μ���0.2000mol��L-1NaOHʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ�������ǻӷ���������˵����ȷ����
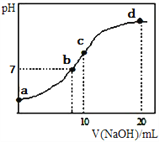
A. ��a��ʾ��Һ�У�c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. ��b��ʾ��Һ�У�c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. ��c��ʾ��Һ�У�c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D. ��d��ʾ��Һ�У�c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ϵ�У�c(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�c(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)�����ϱ�,�÷�Ӧ�ﵽƽ��״̬����ʱ����_________��
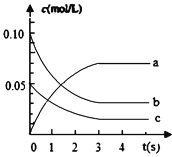
(2)��ͼ�б�ʾNO2��Ũ�ȱ仯������_______________��
(3)��NO��ʾ��0~2s�ڸ÷�Ӧ��ƽ������v=________��
(4)v(NO)��v(O2) = ______________��
(5)�ﵽƽ��״̬ʱO2��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ƿ��Һ�ֱ���FeCl3��Һ��NaCl��Һ��(NH4)2SO4��Һ��MgSO4��Һ�������Լ��п����ڼ������ǵ���
A����ˮ B��NaOH��Һ C��ϡ���� D��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������й��˺�����������Ҫ�õ���������
A. ������ B. �ձ� C. ������ƿ D. �ƾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��һ�������£���1.00molN2(g)��3.00molH2(g)�����һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3(g)��ƽ��Ũ����ͼ��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
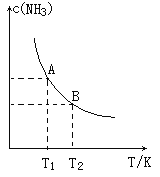
(1)���¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1___________K2(��������������������=��)���ʱ���H___________0��(����������������)
(2)�÷�Ӧ��T1�¶���5.0min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ___________,N2��ת����___________��
(3)T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1=___________��
(4)T1�¶�ʱ������ø�¯��c(N2)=0.5mol/L��c(H2)=0.5mol/L��c(NH3)=0.5mol/L����������£��÷�Ӧ�Ƿ���ƽ��״̬___________(���ǻ��)����ʱ��Ӧ������v��___________v��(�������=)��
��.���������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2(g)+6H2O(l)��4NH3(g)+3O2(g)��
(1)�˷�Ӧ����S 0(����������������)��
��֪2CO(g)+2NO(g)=N2(g)+2CO2(g) ��H="-a" kJ��mol-1
2NO(g)+O2(g)=2NO2(g) ��H ="-b" kJ��mol-1��CO��ȼ������H ="-c" kJ��mol-1��
(2)д����������β����NO2����Ⱦʱ��NO2��CO�ķ�Ӧ���Ȼ�ѧ��Ӧ����ʽ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com