
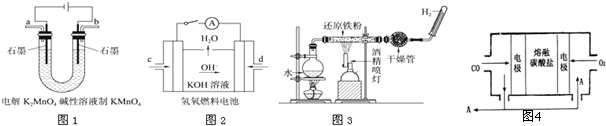


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��150 mL 3 molL-1��KClO3 |
| B��75 mL 2 molL-1��NH4Cl |
| C��150 mL 2 molL-1��CaCl2 |
| D��350 mL 3 molL-1��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
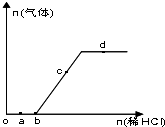 ��Na2CO3��NaHCO3�����Һ����μ���ϡ���ᣬ�����������������������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ�������
��Na2CO3��NaHCO3�����Һ����μ���ϡ���ᣬ�����������������������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ�������| A��a���Ӧ����Һ�У�Na+��OH-��SO42-��NO3- |
| B��b���Ӧ����Һ�У�K+��Al3+��MnO4-��Cl- |
| C��c���Ӧ����Һ�У�Na+��Ca2+��NO3-��Cl- |
| D��d���Ӧ����Һ�У�K+��Fe2+��NO3-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��AB2 |
| B��AB3 |
| C��A2B3 |
| D��A3B2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��120g NaHSO4�����к�HSO4-����ĿΪNA |
| B��Na2O2��������CO2��Ӧ������22.4L����ʱת�Ƶĵ�����Ϊ2NA |
| C����⾫��ͭʱ��ÿת��1mol�����������ܽ��ͭԭ����Ϊ0.5NA |
| D��1L pH=1��H2SO4��Һ�к���H+����ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ϵ��ѹǿ���ֲ��� |
| B����ϵ��������ܶȱ��ֲ��� |
| C������n molNO��ͬʱ����n molCO2 |
| D����ϵ�������ƽ��Ħ���������ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2��3��2 |
| B��3��2��2 |
| C��1��2��3 |
| D��3��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com