
| A. | 乙烯 | B. | 苯 | C. | 甲苯 | D. | 乙酸 |
分析 由选项中物质可知,能使酸性高锰酸钾溶液褪色但不能发生化学反应使溴水褪色的是应为苯的同系物,以此来解答.
解答 解:A.乙烯中含C=C,能使酸性高锰酸钾溶液褪色,也能发生化学反应使溴水褪色,故A不选;
B.苯与溴水、高锰酸钾均不反应,均不能使其褪色,故B不选;
C.甲苯能被高锰酸钾氧化,与溴水不反应,则能使酸性高锰酸钾溶液褪色但不能发生化学反应使溴水褪色,故C选;
D.乙酸与溴水、高锰酸钾都不反应,故D不选,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、苯及其同系物的性质,萃取为解答的易错点,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
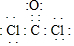
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于500 mL水中 | B. | 溶于1 L水中 | ||
| C. | 溶解后溶液的总体积为500 mL | D. | 溶解后溶液的总体积为1 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量H2与Cl2,H2的分子数比Cl2多 | |
| B. | 摩尔是用来衡量微观粒子多少的物理量 | |
| C. | 0.1molH2SO4含有氢原子数的精确值为1.204×1023 | |
| D. | 0.5mol氢的质量是0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
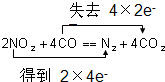
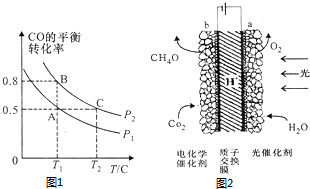
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨制碳酸氢铵 | B. | 制普通玻璃 | ||
| C. | 用铁矿石炼铁 | D. | 汽车用乙醇汽油作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com