
| A. | a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| C. | 向50mL 1mol•L-1明矾溶液中滴入数滴0.1mol•L-1Ba(OH)2溶液:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| D. | 在澄清石灰水中加入少量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.等物质的量反应,亚铁离子全部被氧化,溴离子一半被氧化;
B.电子、电荷不守恒;
C.Ba(OH)2完全反应,不符合离子的配比;
D.反应生成氢氧化镁和碳酸钙、水.
解答 解:A.a mol FeBr2溶液中通入a mol Cl2的离子反应为2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl-,故A正确;
B.向KI与稀硫酸的混合溶液中通入氧气的离子反应为4H++O2+4I-═2I2+2H2O,故B错误;
C.向50mL 1mol•L-1明矾溶液中滴入数滴0.1mol•L-1Ba(OH)2溶液的离子反应为3Al3++2SO42-+2Ba2++6OH-═2Al(OH)3↓+2BaSO4↓,故C错误;
D.在澄清石灰水中加入少量碳酸氢镁溶液的离子反应为Mg2++2Ca2++4OH-+2HCO3-═2CaCO3↓+2H2O+Mg(OH)2↓,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
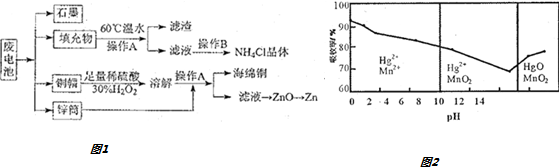
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定时盛待测的锥形瓶中有少量水对滴定结果无影响 | |
| B. | 在酸碱中和滴定实验中,滴定管都需要润洗,否则引起误差 | |
| C. | 滴定时,左手控制滴定管的活塞,右手握持锥形瓶,边滴加振荡,眼睛注视滴定管中的液面 | |
| D. | 在酸碱中和滴定实验中,滴定前仰视滴定后俯视会引起误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积Vm=22.4L/mol,则气体所处的状态为标准状况 | |
| B. | 一定条件下,1.4gN2和0.2molH2混合充分反应,转移的电子数目约为1.806×1023个 | |
| C. | 1.0mol/L的Na3PO4溶液中含有的阴离子总数大于6.02×1022个 | |
| D. | 5.0g乙烷中含有的极性键的数目约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1KHS溶液中c(HS-)+c(S2-)+c(H2S)=0.1mol•L-1 | |
| B. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | pH=11的NaOH溶液与pH=3的CH2COOH溶液等体积混合后c(CH2COO-)>c(Na+)>c(H+)>c(0H-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
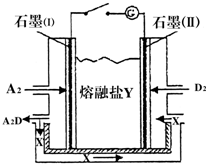 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题:
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 核外电子是分层运动的 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 不同能量的电子在核外运动占有的区域形状可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
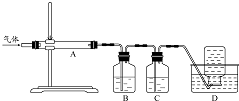 氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:
氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 KCl溶液与1 mol•L-1 K2SO4溶液等体积混合后,c(K+)为2 mol•L-1 | |
| B. | 120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mol•L-1 | |
| D. | 把5 g胆矾溶于45 g水中,所得溶液溶质的质量分数为10% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com