

分析 由Z2Y、Z2Y2可推测是H2O、H2O2或Na2O、Na2O2,又因为Y离子和Z离子具有相同的电子层结构,所以只能是Na2O、Na2O2,由此知Z为Na,Y为O,由于XY2、XY3,可知X可形成?+4、+6价的化合物,且X离子比Y离子多1个电子层,X只能是S,结合对应物质的性质以及题目要求解答该题.
解答 解:由Z2Y、Z2Y2可推测是H2O、H2O2或Na2O、Na2O2,又因为Y离子和Z离子具有相同的电子层结构,所以只能是Na2O、Na2O2,由此知Z为Na,Y为O,由于XY2、XY3,可知X可形成?+4、+6价的化合物,且X离子比Y离子多1个电子层,X只能是S,
(1)由以上分析可知X为硫元素,位于周期表第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(2)Z为钠元素,Na与O能形成Na2O,电子式为 ,故答案为:
,故答案为: ;
;
(3)Z与Y能形成Z2Y2为过氧化钠,该化合物中含有钠离子与过氧根离子形成的离子键和氧原子与氧原子间形成的共价键,故答案为:离子、共价.
点评 本题综合考查原子结构与元素周期律知识,为高考常见题型,侧重于学生的分析能力和基本理论的综合运用,注意把握原子结构特点和对应物质的性质,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×10 12/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
| A. | 钙 | B. | 铁 | C. | 锌 | D. | 钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜 | B. | 氧气 | C. | 二氧化碳 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

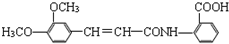 ).
).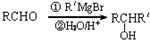
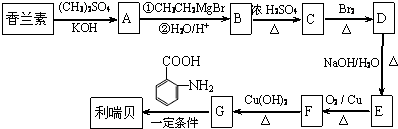
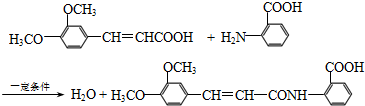
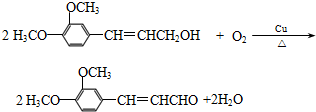
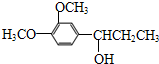 .
.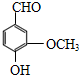 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的溶液 | B. | c(H+)=1×10-5mol/L的溶液 | ||
| C. | c(OH-)=1×10-12 mol/L的溶液 | D. | 0.005 mol/L的H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N5+具有34个电子 | B. | N5+中氮-氮之间是以共价键结合 | ||
| C. | 化合物N5AsF6中As的化合价为+1 | D. | 化合物N5AsF6中F的化合价为-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com