工业制硫酸时,利用催化氧化反应将SO
2转化为SO
3是一个关键的步骤.
(1)某温度下,SO
2(g)+
O
2(g)?SO
3(g);△H=-98kJ?mol
-1.开始时在100L的密闭容器中加入4.0molSO
2(g)和10.0molO
2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
.
(2)下列关于2SO
2(g)+O
2(g)?2SO
3(g)反应的图象中(图1),正确的是
.

(3)SO
2既有氧化性又有还原性,还有漂白性.将SO
2气体通入酸性KMnO
4中,酸性KMnO
4褪色,写出该反应的离子方程式:
.(已知KMnO
4酸性条件下的还原产物为Mn
2+).
(4)标准状况下,将4.48LCO
2通入200mL1.5mol/L的NaOH溶液,所得溶液中各离子浓度由大到小的顺序为
.
(5)如图2是甲醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是
(填“甲醇”或“氧气”),其电极上发生的电极反应式为
.
(6)常温时,BaSO
4的Ksp═1.08x10
-10,现将等体积的BaCl
2溶液与2.0x10-
3mol/l的Na
2SO
4溶液混合.若要生成BaSO
4沉淀,BaCl
2溶液的最小浓度为
.




 物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:
物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:
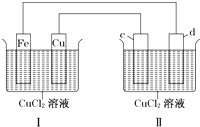 下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:
下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题: